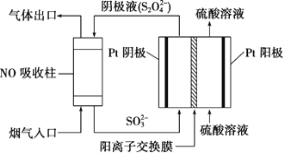
题目内容
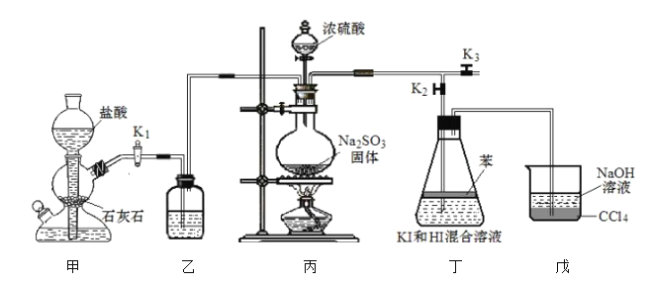
【题目】已知某纯碱试样中含有 NaCl 杂质,为测定试样中纯碱的质量分数,可用下图中的装置进行实验。
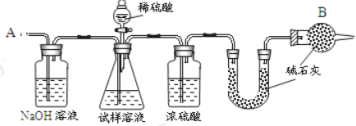
主要实验步骤如下:
①按图组装仪器,并检查装置的气密性;
②将 a g 试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液;
③称量盛有碱石灰的 U 形管的质量,得到 b g;
④从分液漏斗滴入 6 molL-1的硫酸,直到不再产生气体时为止;
⑤从导管 A 处缓缓鼓入一定量的空气;
⑥再次称量盛有碱石灰的 U 型管的质量,得到 c g;
⑦重复步骤⑤和⑥的操作,直到 U 型管的质量基本不变,为 d g;
请填空和回答问题:
(1)第一个洗气瓶中氢氧化钠溶液的作用是____________________
(2)装置中干燥管 B 的作用是_______________________________
(3)如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________(填偏高、偏低或不变)。
(4)步骤⑤的目的是_______________________________________
(5)步骤⑦的目的是_________________________________________
(6)该试样中纯碱的质量分数的计算式为________________________。
【答案】吸收空气中的CO2 防止空气中的二氧化碳和水气进入U型管中 偏高 把反应产生的二氧化碳全部导入U型管中 判断反应产生的二氧化碳是否全部排出,并被U型管中的碱石灰吸收 ![]()
【解析】
实验原理是通过准确测定和酸反应生成的二氧化碳气体的量,计算碳酸钠的量;盐酸的挥发性,空气中含有二氧化碳和水蒸气都会对实验产生干扰,据此回答。
(1)空气中含有二氧化碳,氢氧化钠溶液吸收二氧化碳,防止空气中的二氧化碳气体进入U型管中的碱石灰,干扰实验;
(2)U型管中的碱石灰是为了吸收反应生成的二氧化碳,但空气中也存在二氧化碳,干燥管B的作用就是防止空气中的二氧化碳和水分进入U型管,对结果产生误差。
(3)由于盐酸具有挥发性,也会随着二氧化碳进入U型管,被误认为是二氧化碳,所以二氧化碳的质量偏大,算出的碳酸钠的质量也会偏大的,所以结果会偏大。
(4)由于反应结束后锥形瓶中存留有二氧化碳,鼓入一定量的空气就是将残留的二氧化碳完全排入U型管;步骤⑤的目的是把反应产生的二氧化碳全部导入U型管中;
(5)U型管的质量基本不变,说明二氧化碳已经被全部排到U型管中;步骤⑦的目的是判断反应产生的CO2是否全部排出,并被U型管中的碱石灰吸收;
(6)设需要碳酸钠的质量为X,则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X d-b
列比例式:![]()
解得X=![]() ;
;
所以试样中纯碱的质量分数的计算式为![]()
![]() ;
;

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案