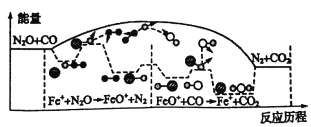
题目内容
【题目】化学小组为探究![]() 在酸性
在酸性![]() 溶液中的反应,利用如图装置进行实验:
溶液中的反应,利用如图装置进行实验:
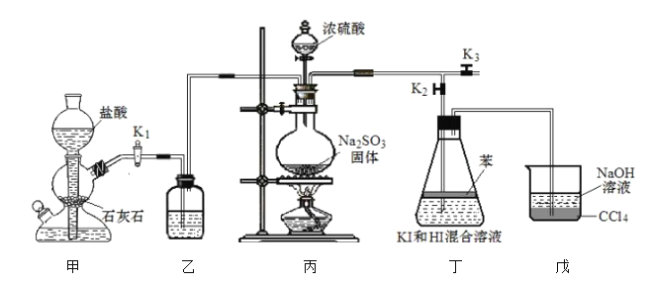
I.排出装置内的空气。减缓![]() 的流速,向丁装置中通入
的流速,向丁装置中通入![]() 和
和![]() 的混合气体。
的混合气体。
Ⅱ.一段时间后,溶液变黄并出现浑浊。摇动锥形瓶、静置,苯与溶液边缘呈紫红色。
Ⅲ.持续向丁装置中通入![]() 和
和![]() 混合气体,溶液变为无色。
混合气体,溶液变为无色。
Ⅳ.再静置一段时间,取锥形瓶中水溶液,滴加![]() 溶液,产生白色沉淀。
溶液,产生白色沉淀。
回答下列问题:
(1)苯的作用为__________。排出装置内空气的具体操作为_________。
(2)向装置丁中缓慢通入![]() 的作用是__________。
的作用是__________。
(3)步骤Ⅱ反应的离子方程式为__________;步骤Ⅲ反应的离子方程式为______________。
(4)实验的总反应为_________,![]() 和
和![]() 在反应中的作用为___________。
在反应中的作用为___________。
【答案】萃取碘单质,隔绝空气防止![]() 被氧化 关闭
被氧化 关闭![]() ,打开
,打开![]() ,打开
,打开![]() 防止倒吸
防止倒吸 ![]()
![]()
![]() 催化剂
催化剂
【解析】
为探究![]() 在酸性
在酸性![]() 溶液中的反应,由于酸性
溶液中的反应,由于酸性![]() 容易被O2氧化,所以加苯液封,同是萃取碘单质,并且在反应前先用二氧化碳将装置内的空气排尽;在反应中分二步进行,第一步,
容易被O2氧化,所以加苯液封,同是萃取碘单质,并且在反应前先用二氧化碳将装置内的空气排尽;在反应中分二步进行,第一步,![]() ,第二步,
,第二步,![]() ;最后用氢氧化钠进行尾气处理,四氯化碳防倒吸。
;最后用氢氧化钠进行尾气处理,四氯化碳防倒吸。
(1)根据分析,装置丁中苯有二个作用:萃取碘单质,隔绝空气防止![]() 被氧化;用二氧化碳排出甲、乙、丙中的空气,打开
被氧化;用二氧化碳排出甲、乙、丙中的空气,打开![]() ,打开
,打开![]() ,关闭
,关闭![]() ;
;
(2)若只将![]() 通入丁中,
通入丁中,![]() 反应后压强减小,会倒吸,通入
反应后压强减小,会倒吸,通入![]() 和
和![]() 混合气体,
混合气体,![]() 不反应,始终有气体排出,起防止倒吸的作用,故答案为:防止倒吸;
不反应,始终有气体排出,起防止倒吸的作用,故答案为:防止倒吸;
(3)步骤Ⅱ中,溶液变黄并出现浑浊,说明生成了硫单质,摇动锥形瓶、静置,苯与溶液边缘呈紫红色,说明生成了碘单质,离子方程式为![]() ;步骤Ⅲ通入
;步骤Ⅲ通入![]() 和
和![]() 混合气体,溶液变为无色,说明碘单质被消耗,离子方程式为:
混合气体,溶液变为无色,说明碘单质被消耗,离子方程式为:![]() ;
;
(4)根据![]() 和
和![]() 反应,将后者的系数扩大2倍,与前一个反应叠加,得总反应为:
反应,将后者的系数扩大2倍,与前一个反应叠加,得总反应为:![]() ;
; ![]() 和
和![]() 在反应前后质量和性质没有发生改变,故其为催化剂。
在反应前后质量和性质没有发生改变,故其为催化剂。

【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向苯酚钠溶液中滴加NaHSO3溶液,溶液变浑浊 | 苯酚酸性弱于H2SO3酸性 |
B | 向AgNO3溶液中逐滴加入浓度均为0.05 mol·L-1的NaI、NaCl混合溶液,有黄色沉淀生成 | Ksp(AgCl)>Ksp(AgI) |
C | 向FeCl3溶液中加入Cu粉,Cu粉溶解 | Cu的还原性大于Fe |
D | 向盛有H2O2溶液的试管中滴几滴酸化的FeCl2溶液,溶液变成棕黄色,一段时间后,溶液中有气泡出现 | 铁离子催化H2O2的分解 |
A.AB.BC.CD.D