题目内容
1.如图.4种短周期元索W、X、Y、Z,它们原子的最外层电子数之和为22.下列说法正确的是(| X | Y | ||
| W | Z | ||
| T |
| A. | X、Y、Z最低价氢化物的沸点依次升高 | |
| B. | X、Y和氢形成的化合物中只有共价键 | |
| C. | WY2、W3X4、WZ4均为原子晶体 | |
| D. | 元素T的单质可作半导体材料,T与Z元素可形成化合物TZ4 |
分析 W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,以此解答该题.
解答 解:W、X、Y、Z为短周期元素,由元素在周期表中位置可知,X、Y处于第二周期,W、Z处于第三周期,令W的最外层电子数为a,则X、Y、Z最外层电子数分别为a+1、a+2、a+3,故a+a+1+a+2+a+3=22,解得a=4,故W为Si、X为N、Y为O、Z为Cl、T为Ge,
A.X、Y、Z三种元素最低价氢化物分别为氨气、水、HCl,常温下水为液态,氨气、HCl为气体,故水的沸点最高,氨气分子之间都存在氢键,沸点比HCl的高,故A错误;
B.N、O和H形成的化合物硝酸铵中既有离子键、又有共价键,故B错误;
C.WY2、W3X4、WZ4分别为SiO2、Si3N4、SiCl4,SiCl4为分子晶体,常温下为液态,故C错误;
D.Ge元素的单质具有半导体的特性,与Cl元素可形成化合物GeCl4,故D正确,
故选D.
点评 本题考查结构性质位置关系应用,为高频考点,侧重于学生的分析能力的考查,推断元素是解题关键,注意A中氢键对物质性质的影响,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.关于下列装置的叙述正确的是( )
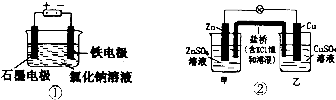

| A. | 装罝①两极均有气泡产生,滴人酚酞溶液后,石墨电极附近溶液变红 | |
| B. | 装置①电解一段时间,加人盐酸溶液可使电解质溶液恢复原状 | |
| C. | 装置②盐桥中的K+向乙池移动 | |
| D. | 装置②反应一段时间后,乙池中溶液的pH变小 |
16.用丙醛制取1,2-丙二醇,其合成路线依次发生的反应类型为( )
| A. | 还原→取代→加成→消去 | B. | 氧化→加成→取代→消去 | ||
| C. | 消去→加聚→取代→还原 | D. | 还原→消去→加成→取代 |
6.下列化学用语正确的是( )
| A. | 聚乙烯的结构简式: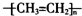 | B. | CH4分子的填充(或比例)模型: | ||
| C. | 乙醇的分子式:CH3CH2OH | D. | 8个中子的碳原子的核素符号:12C |
13.设NA为阿伏伽德罗常数的值,下列说法错误的是( )
| A. | 0.1molMg2+含有NA个电子 | |
| B. | 1mol•L-1的NaCl溶液中含有NA个Na+ | |
| C. | 2molCu与足量S加热充分反应,转移2NA个电子 | |
| D. | 4gCH4与Cl2在光照条件下反应全部转化为CCl4时,断裂NA个C-H键 |
11.下列各组物质气化或熔化时,所克服的微粒间的作用力,属同种类型的是( )
| A. | 氯化钠和铁的熔化 | B. | 二氧化硅和生石灰的熔化 | ||
| C. | 碘和干冰的升华 | D. | 食盐和冰的熔化 |


