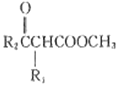题目内容
【题目】天然水大多含Ca2+、Mg2+、HCO3-等离子,加热会产生水垢,水垢中一定含有CaCO3和Mg(OH)2,可能含有MgCO3。
(1)天然水中的HCO3-来自于空气中的CO2。用相关方程式表示CO2溶于水形成HCO3-的过程。______________________________________________________________
(2)天然水煮沸时,其中微溶的MgCO3转换成难溶的Mg(OH)2,写出发生反应的化学方程式。____________________________________________
为确定某水垢样品的成分,利用CaCO3、MgCO3、Mg(OH)2高温分解的性质,精确称量5.000g水垢样品,用如下图装置进行实验。
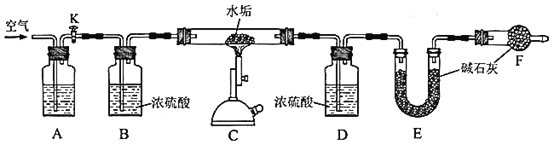
(3)A中盛放的试剂是__________。装置F的作用是_________________________。反应结束后,需要再通入一段时间的空气,目的是_______________________。
(4)利用上述装置测定水垢中Mg(OH)2的含量时,需要测量的数据有__________。
(5)实验测得装置E增重2.200g,请问水垢样品中是否含有MgCO3?判断依据是_______________________________________________________。
【答案】CO2+H2O![]() H2CO3、H2CO3
H2CO3、H2CO3![]() H++HCO3-或CO2+H2O
H++HCO3-或CO2+H2O![]() HCO3-+H+ MgCO3+H2O→Mg(OH)2+CO2 . NaOH溶液 吸收空气中H2O和CO2,防止其进入E中干扰实验测定;排尽装置中的产物CO2和H2O,使其充分被D、E装置吸收 D装置反应前后的质量 含 题中给出的信息是水垢中一定含有CaCO3和Mg(OH)2,若增重2.200g全来自于CaCO3分解产生的CO2,则计算得出CaCO3的质量为5.000g,而样品的总质量为5.000g,与题意不符,因此样品中含有MgCO3
HCO3-+H+ MgCO3+H2O→Mg(OH)2+CO2 . NaOH溶液 吸收空气中H2O和CO2,防止其进入E中干扰实验测定;排尽装置中的产物CO2和H2O,使其充分被D、E装置吸收 D装置反应前后的质量 含 题中给出的信息是水垢中一定含有CaCO3和Mg(OH)2,若增重2.200g全来自于CaCO3分解产生的CO2,则计算得出CaCO3的质量为5.000g,而样品的总质量为5.000g,与题意不符,因此样品中含有MgCO3
【解析】
利用CaCO3、MgCO3、Mg(OH)2高温分解生成CO2、H2O的性质,通过测定分解产物的质量确定水垢样品的成分。紧扣这一实验目的,选择实验试剂、判断装置作用、分析采集数据。
(1)空气中的CO2溶于水、并与水反应生成碳酸:CO2+H2O![]() H2CO3,碳酸微弱电离生成HCO3-:H2CO3
H2CO3,碳酸微弱电离生成HCO3-:H2CO3![]() H++HCO3-。
H++HCO3-。
(2)煮沸天然水时,微溶的MgCO3发生双水解反应生成难溶的Mg(OH)2,总的化学方程式为MgCO3+H2O![]() Mg(OH)2+CO2↑。
Mg(OH)2+CO2↑。
(3)为测定样品分解生成的CO2、H2O的质量,必须使用不含CO2、H2O的空气通入装置,才不会引起测量误差,故A、B装置中分别用NaOH溶液、浓硫酸除去空气中的CO2、H2O;D、E装置分别吸收样品分解生成的H2O、CO2,装置E中碱石灰吸收空气中的CO2、H2O,防止其进入E中干扰实验测定。为保证样品分解产生的H2O、CO2能被D、E装置完全吸收,反应后再通入一段时间的空气,将样品生成的气体导入D、E装置中。
(4)样品中只有Mg(OH)2分解生成H2O,故测定样品分解生成H2O的质量,即可计算Mg(OH)2含量。为此,需要测量D装置在反应前后的质量。
(5)据题意,水垢中一定含有CaCO3和Mg(OH)2,可能含有MgCO3。装置E增重2.200g为CO2质量,二氧化碳的物质的量是0.05mol,若全部来自CaCO3分解,则CaCO3质量为5.000g,不符合题意,故5.000g水垢样品中必含MgCO3。

 名校课堂系列答案
名校课堂系列答案【题目】下列有关物质检验的实验结论正确的是
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有 |
B | 向某溶液中加入2滴KSCN溶液,溶液不显红色;再向溶液中加入几滴新制的氯水,溶液变为红色 | 该溶液中一定含有 |
C | 将某气体通入品红溶液中,品红溶液褪色 | 该气体一定为 |
D | 将少量有机物滴加到新制氢氧化铜溶液中,充分振荡,未见红色沉淀生成 | 该有机物不含醛基 |
A. AB. BC. CD. D