��Ŀ����
ԭ��������С�������е����ֶ�����Ԫ��X��Y�� Z��W����Ԫ�ص�ԭ������֮��Ϊ32�������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ�Y��Z�������ڣ�Z��Wλ��ͬ���塣 MԪ����Xͬ���壬��Wͬ���ڡ�
(1)MԪ����__________����Ԫ�ط��ţ���
(2)Z��W�γɵ���̬������ȶ���Ϊ_______��________�����ѧʽ��
(3)д��M2Z2�ĵ���ʽ_________��д��M2Z2��ˮ��Ӧ�����ӷ���ʽ__________��
(4)��X��Y��Z��W����Ԫ���е�������ɵġ���ǿ�ᣬ��ǿ���ϡ��Һ����ͭ��Ӧ�����ӷ���ʽΪ
__________________________________��
(5)��X��Y��Z��W����Ԫ����ɵ�һ�����ӻ�����A����֪��1molA��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���塣��A�������ᷴӦ��������B��������������ˮ��Ӧ����A��__________
���ѧʽ��.д��������B����ˮ��Ӧ�����ӷ���ʽ__________________________________________��(6)��X��Y�� Z��W��Fe����Ԫ����ɵ���Է�������Ϊ392�Ļ�����C,1mol C�к���6mol�ᾧˮ���Ի�����C������ʵ�飺
a��ȡC����Һ�������ŨNaOH��Һ�����ȣ�������ɫ��������ɫ�̼�����ζ���塣��һ��ʱ���ɫ������Ϊ����ɫ�����ձ�Ϊ���ɫ��
b����ȡC����Һ���������BaCl2��Һ������ɫ������������������ܽ�
��д��C�Ļ�ѧʽΪ_______________________________________��
����д��C��M2Z2�����ʵ�����1:2����Һ�з�Ӧ�Ļ�ѧ����ʽ____________________________��
��1��Na��1�֣� ��2��H2O��2�֣���H2S��2�֣�
��3��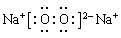 ��2�֣���2Na2O2��2H2O��4Na����4OH����O2����2�֣�
��2�֣���2Na2O2��2H2O��4Na����4OH����O2����2�֣�
��4��3Cu��2NO3����8H����3Cu2����2NO����4H2O��2�֣�
��5��(NH4)2SO3��1�֣���SO2��Cl2��2H2O��SO42����2Cl����4H����2�֣�
��6����(NH4)2Fe(SO4)2��6H2O��2����
��4(NH4)2Fe(SO4)2��6H2O��8 Na2O2��4Fe(OH)3��8NH3��3O2����8Na2SO4��22H2O��2����
��������
��������������ڱ���X��ԭ�Ӱ뾶��С��Ԫ�أ���XӦ������Ԫ�ء�Y��Z�������ڣ������X��Y�� Z��W����Ԫ�ص�ԭ���������������֪��Y��Z�ǵڶ�����Ԫ�ء�Z��Wλ��ͬ���壬��W�ǵ�������Ԫ�ء� MԪ����Xͬ���壬��Wͬ���ڣ�����M�ǵ������ڵ�IA�����Ԫ�ء���Y��ԭ��������a����Y��a��1��W��a��9������X��Y�� Z��W����Ԫ�ص�ԭ������֮��Ϊ32��֪��1+a+a+1+a+9��32�����a��7������Y�ǵ�Ԫ�أ�Z����Ԫ�أ�W����Ԫ�ء�
��1��MԪ����Na��
��2���ǽ�����Խǿ���⻯����ȶ���Խǿ����Ԫ�صķǽ�����ǿ����Ԫ�صķǽ����ԣ�����ˮ���ȶ���ǿ��H2S���ȶ��ԡ�
��3������������������������������ӹ��ɵ����ӻ�����������ʽΪ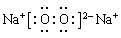 ������������ˮ��Ӧ����������������������Ӧ�����ӷ���ʽΪ2Na2O2��2H2O��4Na����4OH����O2����
������������ˮ��Ӧ����������������������Ӧ�����ӷ���ʽΪ2Na2O2��2H2O��4Na����4OH����O2����
��4����H��N��O��S�е�����Ԫ����ɵ�һ��ǿ������������ᡣ���ڸ�ǿ���ϡ��Һ����ͭ��Ӧ����˸�ǿ��Ӧ�������ᡣ�������ǿ�����ԣ���ͭ��Ӧ�����ӷ���ʽΪ3Cu��2NO3����8H����3Cu2����2NO����4H2O��
��5����H��N��O��S����Ԫ����ɵ�һ�����ӻ�����A����֪��1molA��������NaOHŨ��Һ��Ӧ���ɱ�״����44.8L���壬���AӦ������Σ����ɵ������ǰ��������ʵ�����44.8L��22.4L/mol��2mol����A�������ᷴӦ��������B����AӦ�����������Σ����A��������李������ᷴӦ���ɵ�������SO2��SO2���л�ԭ�ԣ�������ˮ����������ԭ��Ӧ����Ӧ�����ӷ���ʽΪSO2��Cl2��2H2O��SO42����2Cl����4H����
��6����ȡC����Һ�������ŨNaOH��Һ�����ȣ�������ɫ��������ɫ�̼�����ζ���塣��һ��ʱ���ɫ������Ϊ����ɫ�����ձ�Ϊ���ɫ����˵��C�к����������Ӻ�NH4������ȡC����Һ���������BaCl2��Һ������ɫ������������������ܽ⣬��˵��C�к��е���������SO42�������ݻ��ϼۿ�֪�����û�����Ļ�ѧʽ��[(NH4)2Fe(SO4)2]x��6H2O�������û��������Է���������392����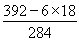 ��1�����Ըû�����Ļ�ѧʽΪ(NH4)2Fe(SO4)2��6H2O��
��1�����Ըû�����Ļ�ѧʽΪ(NH4)2Fe(SO4)2��6H2O��
��������������ˮ���������������������������������ԣ��ܰ����ɵ���������������������������������C��M2Z2�����ʵ�����1:2����Һ�з�Ӧ�Ļ�ѧ����ʽΪ4(NH4)2Fe(SO4)2��6H2O��8 Na2O2��4Fe(OH)3��8NH3��3O2����8Na2SO4��22H2O��
���㣺����Ԫ���������ƶϡ�Ԫ�������ɵ�Ӧ�á�����ʽ��������ԭ��Ӧ����ʽ����д

 H2SO3��H2SO3
H2SO3��H2SO3 H++HSO3-
H++HSO3-
 X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����
X��Y��Z��WΪ��ԭ��������С�������е����ֶ�����Ԫ�أ���֪����X�ɷֱ���Y��W�γ�X2Y��X2Y2��XW�ȹ��ۻ������Z�ɷֱ���Y��W�γ�Z2Y��Z2Y2��ZW�����ӻ����