题目内容
【题目】某同学用下图所示的装置及药品进行比较酸性强弱的实验,一段时间后试管②中有胶冻状物质生成。下列说法正确的是( )
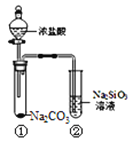
A. 用带有玻璃塞的试剂瓶盛装Na2SiO3溶液
B. 试管①中反应的离子方程式是:Na2CO3+ 2H+ = 2Na+ + CO2↑+ H2O
C. 该实验可以证明酸性:盐酸>碳酸>硅酸
D. 若将盐酸换成硫酸,能证明酸性:硫酸>碳酸>硅酸
【答案】D
【解析】A、Na2SiO3是常见的玻璃粘合剂,会使玻璃塞粘住,拔都拔不下来,不能用带有玻璃塞的试剂瓶盛装Na2SiO3溶液,选项A错误;B、碳酸钠是电解质,溶于水,碳酸钠应拆写成离子,CO32-+2H+=CO2↑+H2O,选项B错误;C、实验的目的是验证盐酸、碳酸、硅酸酸性强弱,①中发生的反应:CO32-+2H+=CO2↑+H2O,盐酸强于碳酸,②反应:CO2+H2O+SiO32-=CO32-+H2SiO3,说明碳酸的酸性强于硅酸,但是盐酸具有挥发性,②中也有可能是挥发出的氯化氢参加反应,产生干扰,选项C错误;D、硫酸是难挥发性酸,对后面实验不产生干扰,能说明酸性:硫酸>碳酸>硅酸,选项D正确。答案选D。

【题目】利用熔融碱焙烧工艺可从铝热法生产金属铬的铬渣(Al、Al2O3、Cr2O3等)中浸出铬和铝,为实现铬和铝的再生利用。其工作流程如下:
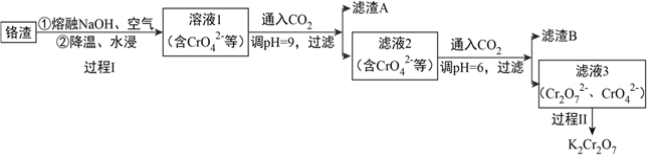
(1)铝热法冶炼金属铬,是利用了金属铝的__________(填“氧化性”或“还原性”)。
(2)溶液1中的阴离子有CrO42-、______、_______。
(3)过程I,在Cr2O3参与的反应中,若生成0.4molCrO42-,消耗氧化剂的物质的量是__________。
(4)通入CO2调节溶液pH实现物质的分离。
①滤渣A煅烧得到Al2O3,再用电解法冶炼Al。冶炼Al的化学方程式是____________________。
②滤渣B受热分解所得物质的参与循环利用,B是__________。
③已知:2CrO42-+2H+ ![]() Cr2O72-+H2O K=4.0×1014
Cr2O72-+H2O K=4.0×1014
滤液3中Cr2O72-的浓度是0.04mol/L,则CrO42-的浓度是__________mol/L。
(5)过程II的目的是得到K2Cr2O7粗品。
不同温度下化合物的溶解度(g/100gH2O)
化合物名称 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
KCl | 28.0 | 34.2 | 40.1 | 45.8 | 51.3 |
K2SO4 | 7.4 | 11.1 | 14.8 | 18.2 | 21.4 |
K2Cr2O7 | 4.7 | 12.3 | 26.3 | 45.6 | 73.0 |
Na2Cr2O7 | 163 | 183 | 215 | 269 | 376 |
结合表中数据分析,过程II的操作是:__________________________,过滤,得到K2Cr2O7粗品。
【题目】有四种短周期元素,它们的结构、性质等信息如下表所述:
元素 | 结构、性质等信息 |
A | 是短周期中(除稀有气体外)原子半径最大的元素,该元素的某种合金是原子反应堆的导热剂 |
B | B与A同周期,其最高价氧化物的水化物呈两性 |
C | 元素的气态氢化物极易溶于水,可用作制冷剂 |
D | 是海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂 |
请根据表中信息填写:
(1)A原子的核外电子排布式 .
(2)B元素在周期表中的位置;离子半径:BA(填“大于”或“小于”).
(3)C原子的电子排布图是 , 其原子核外有个未成对电子,能量最高的电子为轨道上的电子,其轨道呈形.
(4)D原子的电子排布式为 , D﹣的结构示意图是 .
(5)B的最高价氧化物对应的水化物与A的最高价氧化物对应的水化物反应的化学方程式为与D的氢化物的水化物反应的化学方程式为 .