题目内容
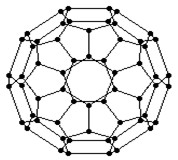
C60分子是形如球状的多面体(如下图),该结构的建立基于以下考虑: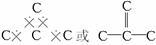
C60的结构
①C60分子中每个碳原子只跟相邻的3个原子形成化学键;②C60分子中只有五边形和六边形;③多面体的顶点数、面数和棱边数的关系,遵循欧拉定理:顶点数+面数-棱边数=2。据上所述,可推知C60分子有12个五边形和20个六边形,C60分子所含的双键数为30。请回答下列问题:
(1)固体C60与金刚石相比较,熔点较高者应是____________,理由是____________________。
(2)试估计C60与F2在一定条件下,能否发生反应生成C
(3)通过计算确定C60分子所含单键数。C60分子所含单键数为__________。
(4)C70分子也已制得,它的分子结构模型可以与C60同样考虑而推知。通过计算确定C70分子中五边形和六边形数目。C70分子所含五边形数为__________,六边形数为__________。
解析:(1)熔点:原子晶体>分子晶体。金刚石是原子晶体,C60是分子晶体,每个C60分子是60个C原子构成的。
(2)由题意,C60分子中含有30个C=C双键,能与30个F2分子发生加成反应,生成C
(3)每个C原子,与周围的C原子以4个共用电子对连接。即如下图所示(外围C原子未标注):
![]()
C60分子中双键数为30,则单键数为60。
(4)设C70分子中五边形、六边形个数分别是x、y。由于每个棱被两个面共有,则根据欧拉定理得
70+x+y-![]() =2。
=2。
每个五边形平均拥有C原子:![]() ,每个六边形平均拥有C原子
,每个六边形平均拥有C原子![]() ,由题意得
,由题意得![]() 。
。
由以上两式解得![]()
答案:(1)金刚石 金刚石是原子晶体,C60是分子晶体
(2)可能 C60分子中含30个双键,加成生成C
(3)60 (4)12 25

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案 为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施.化学反应的焓变通常用实验进行测定,也可进行理论推算.