题目内容
工业制硫酸的关键步骤之一为SO2的接触氧化:2SO2(g)+O2(g)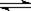 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol
现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
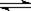 2SO3(g);△H=-196.6kJ/mol
2SO3(g);△H=-196.6kJ/mol现在一容积为2 L的密闭容器中充入2 mol SO2、1 molO2,加入固体催化剂,保持温度在450℃使之发生反应,5 min时达到平衡,测得平衡时体系的压强减小了30%。下列说法正确的是
| A.SO2的转化率为30% |
| B.反应共放出了196.6 kJ的热量 |
| C.用SO2表示的5 min内的平均反应速率为0.36 mol·L—1.min—1 |
| D.相同条件下,起始时若加入2 molSO3,达到的平衡状态完全相同 |
D
2SO2(g)+O2(g)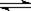 2SO3(g)
2SO3(g)
起始 2 1 0
转化 2x x 2x
平衡 2-2x 1-x 2x
由于平衡时压强减少30%,则(2-2x)+(1-x)+2x=3×70%
X=0.9mol
所以SO2的转化率为90%,反应放热为196.6×90%=176.94kJ,用SO2表示的5 min内的平均反应速率为1.8mol÷2L÷5min="0.18" mol·L—1.min—1
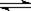 2SO3(g)
2SO3(g)起始 2 1 0
转化 2x x 2x
平衡 2-2x 1-x 2x
由于平衡时压强减少30%,则(2-2x)+(1-x)+2x=3×70%
X=0.9mol
所以SO2的转化率为90%,反应放热为196.6×90%=176.94kJ,用SO2表示的5 min内的平均反应速率为1.8mol÷2L÷5min="0.18" mol·L—1.min—1

练习册系列答案
相关题目
 2O3的平衡体系,已知O2的转化率为20%,下列浓度(c)变化曲线正确的是( )
2O3的平衡体系,已知O2的转化率为20%,下列浓度(c)变化曲线正确的是( )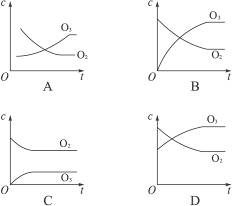
 2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),经过2分钟后达平衡,平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.04 mol·L-1,则下列判断不合理的是( )
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0),经过2分钟后达平衡,平衡时X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.04 mol·L-1,则下列判断不合理的是( )

 2A(g) + 2B(g) 3C(g) ; △H<0.下列说法不正确的是
2A(g) + 2B(g) 3C(g) ; △H<0.下列说法不正确的是 2Z
2Z 2SO3的化学平衡体系中,各物质的浓度分别是:SO2:2mol/L,O2 : 0.8mol/L,SO3 : 2.4mol/L,则氧气在起始时的浓度可能是 ( )
2SO3的化学平衡体系中,各物质的浓度分别是:SO2:2mol/L,O2 : 0.8mol/L,SO3 : 2.4mol/L,则氧气在起始时的浓度可能是 ( ) Fe(SCN)3+3NH4Cl
Fe(SCN)3+3NH4Cl B(气)+ 3C(气),若知所得混合气体对氢气的相对密度为4.25,则A的化学式量可能为
B(气)+ 3C(气),若知所得混合气体对氢气的相对密度为4.25,则A的化学式量可能为