题目内容
【题目】在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O反应中,
(1)氧化剂是__,氧化产物是__.
(2)写出该反应的离子方程式.__.
(3)若有219gHCl参加反应,产生Cl2的体积(标况下)为__ L,转移电子__ mol.
(4)Cl2有毒,多余的Cl2通常用氢氧化钠溶液吸收,反应的离子方程式为:__.
【答案】 KClO3 Cl2 ClO3﹣+5Cl﹣+6H+=3Cl2↑+3H2O 67.2 L 5mol Cl2+2OH﹣=ClO﹣+ClO﹣+H2O
【解析】(1)该反应中,氯酸钾中氯元素的化合价由+5价变为0价,所以氯酸钾是氧化剂;HCl中Cl元素化合价由-1价升高到0价被氧化生成![]() ,为氧化产物;正确答案: KClO3 ; Cl2 。
,为氧化产物;正确答案: KClO3 ; Cl2 。
(2)KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O反应中,氯气、水在离子反应中保留化学式,则该反应的离子反应为ClO3﹣+5Cl﹣+6H+=3Cl2↑+3H2O;正确答案:ClO3﹣+5Cl﹣+6H+=3Cl2↑+3H2O。
(3)根据反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O可知,6molHCl参加反应生成氯气3 mol,若有![]() 即
即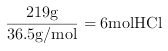 参加反应,则产生
参加反应,则产生![]() 的体积(标况下)为
的体积(标况下)为![]() ,根据
,根据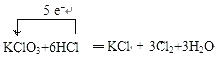 可知转移电子
可知转移电子![]() ,正确答案是:67.2 L ; 5mol。
,正确答案是:67.2 L ; 5mol。
(4)![]() 有毒,多余的
有毒,多余的![]() 通常用氢氧化钠溶液吸收生成氯化钠、次氯酸钠和水,离子方程式为: Cl2+2OH﹣=ClO﹣+ClO﹣+H2O;正确答案: Cl2+2OH﹣=ClO﹣+ClO﹣+H2O。
通常用氢氧化钠溶液吸收生成氯化钠、次氯酸钠和水,离子方程式为: Cl2+2OH﹣=ClO﹣+ClO﹣+H2O;正确答案: Cl2+2OH﹣=ClO﹣+ClO﹣+H2O。

【题目】向1L含0.01molNaAlO2和0.02molNaOH的溶液中缓慢通入二氧化碳,随n(CO2)增大,先后发生三个不同的反应,当0.01mol<n(CO2) ![]() 0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
0.015时发生的反应是:2 NaAlO2+ CO2+2H2O=2Al(OH)3↓+Na2CO3下列对应关系正确的是( )
选项 | n(CO2)/mol | 溶液中离子的物质的量浓度 |
A | 0 | c(Na+)>c(AlO2-)+c(OH-) |
B | 0.01 | c(Na+)>c(AlO2-)> c(OH-)>c(CO32-) |
C | 0.015 | c(Na+)> c(HCO3-)>c(CO32-)> c(OH-) |
D | 0.03 | c(Na+)> c(HCO3-)> c(OH-)>c(H+) |
A. A B. B C. C D. D