题目内容
已知反应
PCl5(g)  PCl3(g)+Cl2(g) ①
PCl3(g)+Cl2(g) ①
2HI(g)  H2(g)+I2(g) ②
H2(g)+I2(g) ②
2NO2(g) N2O4(g) ③
N2O4(g) ③
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率( )
| A.均不变 |
| B.均增大 |
| C.①增大,②不变,③减少 |
| D.①减少,②不变,③增大 |
D
解析

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
升高温度时,化学反应速率加快,主要原因是( )
| A.分子运动速率加快,使该反应物分子的碰撞机会增多 |
| B.反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
| C.该化学反应的过程是吸热的 |
| D.该化学反应的过程是放热的 |
[双选题]实验室用锌粒与2 mol·L-1硫酸溶液制取氢气,下列措施不能增大化学反应速率的是( )
| A.向该硫酸溶液中加入等体积的水 |
| B.改用3 mol·L-1盐酸 |
| C.改用热的2 mol·L-1硫酸溶液 |
| D.用锌粉代替锌粒 |
[双选题]700℃时,向容积为2 L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)  CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
CO2(g)+H2(g)。反应过程中测定的部分数据见下表(表中t2>t1):
| 反应时间/min | n(CO)/mol | n(H2O)/mol |
| 0 | 1.20 | 0.60 |
| t1 | 0.80 | |
| t2 | | 0.20 |
下列说法正确的是( )
A.反应在t1 min内的平均速率为v(H2)=0.40/t1 mol·L-1·min-1
B.保持其他条件不变,起始时向容器中充入0.60 mol CO和1.20 mol H2O,达到平衡时n(CO2)=0.40 mol
C.保持其他条件不变,向平衡体系中再通入0.20 mol H2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数增大
D.温度升高至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
在容积可变的密闭容器中,2 mol N2和8 mol H2在一定条件下发生反应,达到平衡时,H2的转化率为25%,则平衡时氮气的体积分数接近于( )
| A.5% | B.10% | C.15% | D.20% |
CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示,下列结论不正确的是( )
| A.反应开始2 min内平均反应速率最大 |
| B.反应速率先增大后又减小 |
| C.反应开始4 min内温度对反应速率的影响比浓度大 |
| D.反应在第2 min到第4 min间生成CO2的平均反应速率为v(CO2)=0.1 mol·min-1 |
N2O5是一种新型硝化剂,其性质和制备受到人们的关注。一定温度下,在2 L固定容积的密闭容器中发生反应:2N2O5(g) 4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确的是( )
4NO2(g)+O2(g) ΔH>0。反应物和部分生成物的物质的量随反应时间变化的曲线如图所示。下列说法中不正确的是( )
| A.曲线a表示NO2的物质的量随时间的变化 |
| B.10 s时,v(正)>v(逆) |
| C.20 s时反应达到平衡 |
| D.0~20 s内平均反应速率v(O2)=0.05 mol·L-1·s-1 |
 2C﹢D反应中,表示该反应速率最快的是( )
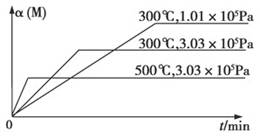
2C﹢D反应中,表示该反应速率最快的是( ) 3C(g)+D(s) ΔH1>0,②xM(g)+N(g)
3C(g)+D(s) ΔH1>0,②xM(g)+N(g) 3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。
3Q(g) ΔH2。反应①中各物质与反应②中各物质均不发生反应。在某容器里只进行反应②,M的转化率与温度、压强的关系如图所示。