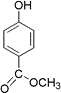
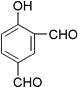
题目内容
【题目】用0.1mol·L-1 NaOH溶液分别滴定10mL相同浓度的盐酸和醋酸(溶质用HA表示),利用导率传感器绘制电导率曲线如图所示(电导率的物理意义是表示物质导电的性能)。下列有关叙述错误的是( )
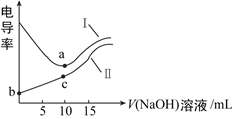
A. 曲线I为盐酸,曲线Ⅱ为醋酸溶液
B. a点、c点均为滴定终点
C. c点:c(Na+) > c(A-) > c(H+) > c(OH-)
D. b点pH值大于1
【答案】C
【解析】溶液导电能力与离子浓度成正比,醋酸是弱电解质,溶液中离子浓度较小,加入氢氧化钠后,溶液中离子浓度增大,溶液导电性增强,HCl是强电解质,随着氢氧化钠溶液加入,溶液体积增大,导致溶液中离子浓度减小,溶液导电能力减弱,当完全反应时离子浓度最小,继续加入氢氧化钠溶液,离子浓度增大,溶液导电能力增强,根据图知,曲线I代表0.1mol·L-1 NaOH溶液滴定10mLHCl溶液的滴定曲线,曲线Ⅱ代表0.1mol·L-1 NaOH溶液滴定10mL醋酸溶液的滴定曲线。
A.由分析可知曲线Ⅰ代表盐酸,曲线Ⅱ代表醋酸溶液,选项D正确; B.a点、c点均为消耗氢氧化钠的体积为10mL,恰好完全中和达到滴定终点,选项B正确;C.c点是醋酸与氢氧化钠恰好完全反应生成醋酸钠,溶液呈碱性,所以离子浓度的大小为:c(Na+)>c(A-)>c(OH-)>c(H+),选项C错误;D.曲线Ⅱ为醋酸溶液,所以b点pH值大于1,选项D正确;答案选C。

练习册系列答案
相关题目