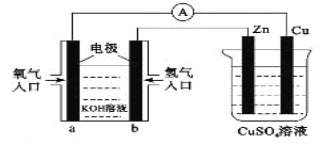
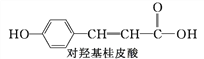
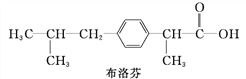
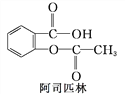
题目内容
【题目】据报道,在火星和金星大气层中发现了一种非常特殊的会导致温室效应的气态化合物,它的结构式为:16O=C=18O。下列说法正确的是( )
A. 1.12L16O=C=18O与1.12L16O=C=16O均含有0.1NA个氧原子
B. 16O=C=18O与16O=C=16O互为同位素
C. 质量相同的16O=C=18O和16O=C=16O 含有相同的中子数
D. 16O=C=18O和16O=C=16O在相同条件下密度比为23:22
【答案】D
【解析】
16O=C=18O的摩尔质量为46g/mol、质子数为22、中子数为24,16O=C=16O的摩尔质量为44g/mol、质子数为22、中子数为22。
A项、没有明确标准状况,无法计算一定体积气体的物质的量,故A错误;
B项、16O=C=18O与16O=C=16O为化合物,而质子数相同、但中子数不同的原子互为同位素,故B错误;
C项、16O=C=18O的摩尔质量为46g/mol、中子数为24,16O=C=16O的摩尔质量为44g/mol、中子数为22,质量相同的16O=C=18O和16O=C=16O 含有的中子数分别为![]() ×24mol和
×24mol和![]() ×22mol,故C错误;
×22mol,故C错误;
D项、在相同条件下密度比等于摩尔质量比,16O=C=18O的摩尔质量为46g/mol,16O=C=16O的摩尔质量为44g/mol,则密度比为46:44=23:22,故D正确。
故选D。

 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案【题目】某化学反应中,设反应物的总能量为E1,生成物的总能量为E2,
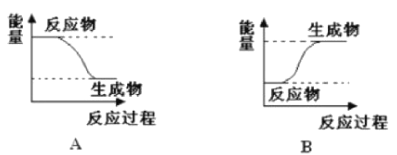
(1)若E1>E2,则该反应为_____________(填“放热”或“吸热”)反应。该反应可用图_____________(填“A”或“B”)表示。
(2)若E1<E2,则该反应为_____________(填“放热”或“吸热”)反应。该反应可用图___________(填“A”或“B”)表示
(3)太阳能的开发和利用是21世纪的一个重要课题。
①利用储能介质储存太阳能的原理是白天在太阳照射下,某种盐熔化,吸收热量;晚间熔盐释放出相应能量,从而使室温得以调节。已知下列数据:
盐 | 熔点/℃ | 熔化吸热KJ·mol-1 | 参考价格/元 |
CaCl2·6H2O | 29.0 | 37.3 | 780850 |
Na2SO4·l0H2O | 32.4 | 77.0 | 800900 |
Na2HPO4·12H2O | 36.1 | 100.1 | 1600-2000 |
Na2S2O3·5H2O | 48.5 | 49.7 | 1400-1800 |
其中最适宜作储能介质的一种盐是_____________(填字母)。
A CaCl2·6H2O
B Na2SO4·l0H2O
C Na2HPO4·12H2O
D Na2S2O3·5H2O
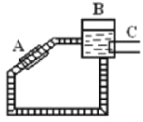
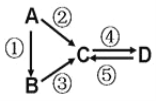
②图是一种太阳能热水器的示意图,图中A是集热器,B是储水容器,C是供阴天时加热的辅助电热器。根据对水的密度的认识,你估计在阳光照射下水将沿_________(填“顺”或“逆”)时针方向流动。