题目内容
【题目】某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+.为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据流程图,填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实验方案.
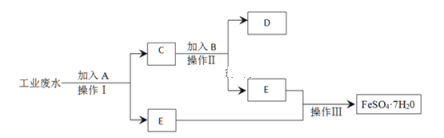
(1)A、B、D分别为_______、______、____________。
(2)操作Ⅱ、操作Ⅲ分别是_____________、_____________________。
【答案】铁粉 稀硫酸 铜 过滤 蒸发浓缩、冷却结晶
【解析】
(1)某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,可加过量铁,铁在金属活动顺序表中排在铜的前面,铁粉把铜置换出来,过滤出Cu,过量Fe.滤液是FeSO4溶液;
(2)要分离不溶于水的固体和液体,可用过滤的方法;从溶液中获得结晶水合物,用结晶的方法。
(1)工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+,要回收硫酸亚铁和铜,先加过量铁粉把铜置换出来,Cu2++Fe=Fe2++Cu,再过滤,废水中剩下FeSO4和少量的Na+,滤渣中铁粉、铜加H2SO4得到FeSO4,合并两溶液。
故答案为:Fe;H2SO4;Cu;
(2)操作Ⅰ加铁粉,Cu2++Fe=Fe2++Cu,过滤,废水E中剩下FeSO4和少量的Na+,加入C中的B为H2SO4,因为铁粉、铜中加入适量稀硫酸,稀硫酸和铁粉反应,生成硫酸亚铁,分离不溶于水的固体和液体,用过滤,回收硫酸亚铁,需采用冷却结晶,
故答案为:过滤;蒸发浓缩、冷却、结晶;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目