题目内容
(18分)已知可逆反应CO2(g) + H2(g) CO(g) + H2O(g),
CO(g) + H2O(g),
⑴写出该反应的化学平衡常数表达式:K= 。
⑵830K时,若起始时:c (CO2)=2mol/L,c (H2)=3mol/L,平衡时CO2的转化率为60%,氢气的转化率为 ;K值为 。
⑶830K时,若只将起始时c (H2)改为6mol/L,则氢气的转化率为 。
⑷若830K时,起始浓度c (CO2) =" a" mol/L,c (H2) =" b" mol/L,H2O的平衡浓度为c (H2O) =" c" mol/L,则:①a、b、c之间的关系式是 ;②当a = b时,a = c。
⑴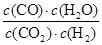 (3分) ⑵40%(3分), 1(3分) ⑶25%(3分)
(3分) ⑵40%(3分), 1(3分) ⑶25%(3分)
①c2=(a-c) (b-c) (3分) ② a=2c(3分)
解析试题分析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,则根据CO2(g) + H2(g) CO(g) + H2O(g)可知,该反应的平衡常数表达式为:K═
CO(g) + H2O(g)可知,该反应的平衡常数表达式为:K═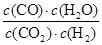 。
。
(2)平衡时CO2的转化率为60%,则消耗CO2的浓度是2mol/L×0.6=1.2mol/L,所以根据反应式CO2(g) + H2(g) CO(g) + H2O(g)可知消耗氢气的浓度是1.2mol/L,所以氢气的转化率为
CO(g) + H2O(g)可知消耗氢气的浓度是1.2mol/L,所以氢气的转化率为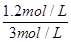 ×100%=40%。平衡时剩余CO2和氢气的浓度分别是0.8mol/L、1.8mol/L,生成CO和水蒸气的浓度均是1.2mol/L,所以该温度下反应的平衡常数K=
×100%=40%。平衡时剩余CO2和氢气的浓度分别是0.8mol/L、1.8mol/L,生成CO和水蒸气的浓度均是1.2mol/L,所以该温度下反应的平衡常数K=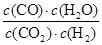 =
=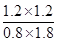 =1。
=1。
(3)830K时,若只将起始时c (H2)改为6mol/L,设消耗氢气的浓度为x,则
CO2(g) + H2(g) CO(g) + H2O(g)
CO(g) + H2O(g)
起始浓度(mol/L) 2 6 0 0
转化浓度(mol/L) x x x x
平衡浓度(mol/L) 2-x 6-x x x
所以根据平衡常数K可知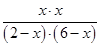 =1
=1
解得x=1.5
所以氢气的转化率为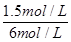 ×100%=25%
×100%=25%
(4)①若830K时,起始浓度c (CO2) =" a" mol/L,c (H2) =" b" mol/L,H2O的平衡浓度为c (H2O) =" c" mol/L,则
CO2(g) + H2(g) CO(g) + H2O(g)
CO(g) + H2O(g)
起始浓度(mol/L) a b 0 0
转化浓度(mol/L) c c c c
平衡浓度(mol/L) a-c b-c c c
所以根据平衡常数K可知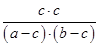 =1
=1
解得c2=(a-c) (b-c)
②当当a=b时,则根据c2=(a-c) (b-c)可知a=2c。
考点:考查可逆反应、平衡常数的有关计算与应用

 阅读快车系列答案
阅读快车系列答案(16分)化学反应的能量变化、速率、限度是化学研究的重要内容。
(1)有关研究需要得到C3H8(g) = 3C(石墨,s) + 4H2(g)的ΔH,但测定实验难进行。设计下图可计算得到:
①ΔH 0(填>、<或=)
②ΔH =
(用图中其它反应的反应热表示)
(2)甲酸、甲醇、甲酸甲酯是重要化工原料。它们的一些性质如下:
| 物质 | HCOOH | CH3OH | HCOOCH3 |
| 主要 性质 | 无色液体,与水互溶 K(HCOOH)>K(CH3COOH) | 无色液体,与水互溶 | 无色液体,在水中溶解度小,与醇互溶 |
 HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。
HCOOH(l) + CH3OH(l),反应吸热,但焓变的值很小。常温常压下,水解反应速率和平衡常数都较小。①工业生产中,反应起始,在甲酸甲酯和水的混合物中加入少量甲酸和甲醇,从反应速率和限度的角度分析所加甲酸和甲醇对甲酸甲酯水解的影响。
甲醇: 。
甲酸: 。
某小组通过试验研究反应HCOOCH3转化率随时间变化的趋势,在温度T1下,采用酯水比为1:2进行实验,测得平衡是HCOOCH3的转化率为25%。
②预测HCOOCH3转化率随时间的变化趋势并画图表示。

③该反应在温度T1下的平衡常数K= 。
(保留两位有效数字)
(3)HCOOH成为质子膜燃料电池的燃料有很好的发展前景。
写出该燃料电池的电极反应式:
。
已知A(g)+B(g) C(g)+D(g)反应的平衡常数和温度的关系如下:
C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K= , △H 0(填“<”“ >”“ =”);
(2)830℃时,向一个5 L的密闭容器中充入0.20mol的A和0.80mol的B,若反应初始6s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。,则6s时 c(A)= mol·L-1, C的物质的量= mol;
若经一段时间后,反应达到平衡,则此时A的转化率= ,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率 ( 填“变大”或“变小”或“不变”);
(3)判断该反应达到平衡的依据为 (填正确选项前的字母):
A.压强不随时间改变
B.气体的密度不随时间改变
C.c(A)不随时间改变
D.单位时间里生成C和D的物质的量相等
(4)1200℃时反应C(g)+D(g)
 A(g)+B(g)的平衡常数的值为 。
A(g)+B(g)的平衡常数的值为 。 在2 L密闭容器内,800 ℃时反应2NO(g)+O2(g) 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |

(1)上图表示NO2的浓度变化的曲线是 。用O2表示从0~2 s内该反应的平衡速率v= 。
(2)能说明该反应已达到平衡状态的是 。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
 CH3OH(g)。工业上依此用CO生产燃料甲醇。
CH3OH(g)。工业上依此用CO生产燃料甲醇。

 增大的有____________。
增大的有____________。 2CO2(g)+ N2(g);△H<0。
2CO2(g)+ N2(g);△H<0。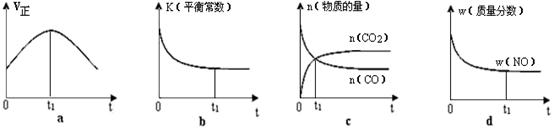
 Li1-xMnO4 + LixC
Li1-xMnO4 + LixC LiMnO4 + C
LiMnO4 + C xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图:
xC(g),在不同条件下生成物C在反应混合物中的质量分数(C%)和反应时间(t)的关系如下图: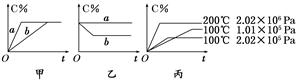
 3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。
3C(g),已知加入1molA和3molB且达到平衡后,生成了a molC。