题目内容
8.下列电子式中,正确的是( )| A. |  | B. |  | C. |  | D. |  |
分析 A、N原子的最外层有5个电子;
B、氢氧根为阴离子,应表示出最外层电子和所带的负电荷;
C、HCl为共价化合物,H原子和Cl原子之间为共价键;
D、氯化镁是离子化合物,由2个氯离子和1个镁离子构成.
解答 解:A、NH3属于共价化合物,不存在离子键,分子中存在3对共用电子对,氮原子最外层为8个电子,故NH3的电子式为: ,故A错误;
,故A错误;
B、氢氧根为阴离子,应表示出最外层电子和所带的负电荷,且H原子核O原子之间为共价键,故电子式为 ,故B正确;
,故B正确;
C、HCl为共价化合物,H原子和Cl原子之间为共价键,故HCl的电子式为 ,故C错误;
,故C错误;
D、氯化镁是离子化合物,由2个氯离子和1个镁离子构成,而氯离子是阴离子,应表示出最外层电子并带一个负电荷,故氯化镁的电子式为 ,故D错误.
,故D错误.
故选B.
点评 本题考查了常见的化学用语--电子式的书写,应注意区分共价化合物和离子化合物电子式的书写方式的区别,难度不大.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
18.下列有关高分子化合物的说法不正确的是( )
| A. | 丙烯(CH3CH=CH2)在一定条件下加聚后可得聚丙烯: | |
| B. | 某塑料 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 可由CF2=CF2和CF2=CFCF3通过加聚反应制得 | |
| C. | 合成高分子  的单体是CF2=CF2 的单体是CF2=CF2 | |
| D. | 一种全降解塑料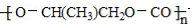 可由 可由  和 CO2在催化剂作用下加聚生成 和 CO2在催化剂作用下加聚生成 |
19. 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )
 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间的转化关系如图所示(反应条件己略去).下列有关物质的推断正确的是( )| 甲 | 乙 | 丙 | 丁 | |
| A | N2 | NO | NO2 | O2 |
| B | CO32- | HCO3- | CO2 | H+ |
| C | Cl2 | FeCl3 | FeCl2 | Fe |
| D | Al3+ | Al(OH)3 | AlO2- | NH3•H2O |
| A. | A | B. | B | C. | C | D. | D |
16.有机物A经氧化后得B(化学式为C2H3O2Br),而A经水解得D,1molD和2molB反应得到一种含溴的酯(C6H8O4Br2).由此推断A的结构简式为( )
| A. | Br-CH2CH2OH | B. |  | C. |  | D. | HOCH2CH2OH |
3.锶(Sr)元素广泛存在于矿泉水中,是一种人体必需的微量元素.用天青石(主要成分为SrSO4,含有少量BaCO3、FeO、Fe2O3、Al2O3、SiO2等)制备SrCO3,工艺流程如图1:

已知:
(1)“浸取转化”过程中发生的化学方程式为:SrSO4+Na2CO3=SrCO3+Na2SO4;当转化完全时,混合液中的c(CO32-)=1.0×10-3mol•L-1,则c(SO42-)=2.0mol/L.
(2)滤渣1的主要成分为SiO2.
(3)“除钡”过程中硫酸不要过量,原因是硫酸过量后会生成SrSO4沉淀,降低产率.
(4)“沉淀”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3↓+H2O+CO2↑.沉淀过程中,温度对Sr2+生成SrCO3反应转化率的影响见图2,60℃之前,锶转化率随温度升高而变大的主要原因是升温有利于CO2的逸出.
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3.

已知:
| SrSO4 | BaSO4 | SrCO3 | |
| Ksp | 3.2×10-7 | 1.1×10-10 | 1.6×10-10 |
(2)滤渣1的主要成分为SiO2.
(3)“除钡”过程中硫酸不要过量,原因是硫酸过量后会生成SrSO4沉淀,降低产率.
(4)“沉淀”生成SrCO3的离子方程式为Sr2++2HCO3-=SrCO3↓+H2O+CO2↑.沉淀过程中,温度对Sr2+生成SrCO3反应转化率的影响见图2,60℃之前,锶转化率随温度升高而变大的主要原因是升温有利于CO2的逸出.
(5)以SrCO3粉作原料经高温焙烧分解成SrO,再将SrO与铝粉充分混合并压制,真空环境下通过热还原反应可制得金属Sr,同时获得3SrO•Al2O3渣团.请写出热还原反应的化学方程式6SrO+2Al$\frac{\underline{\;\;△\;\;}}{\;}$3Sr+3SrO•Al2O3.
13.下列液体分别和溴水混合并振荡,静置后分为两层,水层、油层均为无色的是( )
| A. | 苯酚 | B. | 戊炔 | C. | CCl4 | D. | NaOH溶液 |
17.下列对一些实验事实和理论解释正确的是( )
| 选项 | 实验事实 | 理论解释 |
| A | HCl气体溶于水,能电离出H+、Cl- | HCl为离子化合物 |
| B | HBr的酸性强于HCl的酸性 | Br的非金属性比Cl强 |
| C | HF的沸点高于HCl | F的非金属性比Cl强 |
| D | K3C60在熔融状态下能够导电 | K3C60中含有离子键 |
| A. | A | B. | B | C. | C | D. | D |
18.下列各组混合物,只要总物质的量一定,无论按什么比例混合,完全燃烧后生成的CO2和消耗的氧气都是恒量的是( )
| A. | C2H2、C2H4O | B. | C2H4、C4H6 | C. | C3H8、C3H6 | D. | C6H6、C2H2 |
 .
.