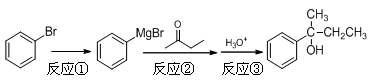
题目内容
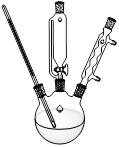
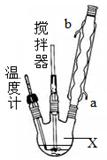
如图所示,分馏装置中,如果有错误请指出并加以改正:
(1) _____________________________,
(2) _____________________________,
(3) _____________________________。
(1)蒸馏烧瓶中温度计水银球应在支管口处,而不应插在液面下
(2)冷凝管的冷水流向是错误的,应从a处流入b处流出
(3)接收仪器应用小口的锥形瓶,而不应用大口的烧杯,以免蒸气挥发太多
解析

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案过氧化尿素是一种新型漂白、消毒剂,广泛应用于农业、医药、日用化工等领域。用低浓度的双氧水和饱和尿素溶液在一定条件下可以合成过氧化尿素。反应的方程式为:CO(NH2)2+H2O2 CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
CO(NH2)2·H2O2。过氧化尿素的部分性质如下:
| 分子式 | 外观 | 热分解温度 | 熔点 | 溶解性 |
| CO(NH2)2?H2O2 | 白色晶体 | 45℃ | 75~85℃ | 易溶于水、有机溶剂 |

请回答下列问题:
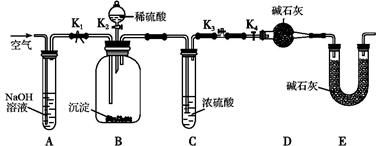
(1)仪器X的名称是 ;冷凝管中冷却水从 (填“a”或“b”)口进入;
(2)反应器的加热方式是 。
(3)搅拌器是否可用铁质材料 (填“是”或“否”),原因是 ;
(4)步骤①采用减压蒸发的原因是 。
(5)母液可以循环使用提高原料利用率,若欲从母液中分离出H2O2和尿素, 可采用的操作是
A.盐析、过滤 B.减压蒸馏、结晶
C.分液、过滤 D.常压蒸馏、萃取
(6)准确称取0.5000g产品于250mL锥形瓶中,加适量蒸馏水溶解,再加1mL6mol·L-1H2SO4,用0.1000mol?L-1KMnO4标准溶液滴定至终点时消耗20.00mL(尿素与KMnO4溶液不反应),则产品中CO(NH2)2?H2O2的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,则测得的过氧化尿素含量 (填“偏高”、“偏低”或“不变”)。
TiO2既是制备其他含钛化合物的原料,又是一种性能优异的白色颜料。
(1)实验室利用反应TiO2(s)+2CCl4(g)=TiCl4(g)+CO2(g),在无水无氧条件下,制取TiCl4实验装置示意图如下: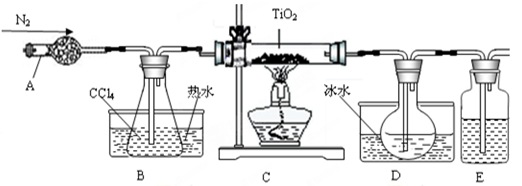
有关性质如下表
| 物质 | 熔点/℃ | 沸点/℃ | 其他 |
| CCl4 | -23 | 76 | 与TiCl4互溶 |
| TiCl4 | -25 | 136 | 遇潮湿空气产生白雾 |
(2)工业上由钛铁矿(FeTiO3)(含Fe2O3、SiO2等杂质)制备TiO2的有关反应包括:
酸溶FeTiO3(s)+2H2SO4(aq)=FeSO4(aq)+ TiOSO4(aq)+ 2H2O(l)
水解TiOSO4(aq)+ 2H2O(l)
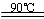 H2TiO3(s)+H2SO4(aq)
H2TiO3(s)+H2SO4(aq)简要工艺流程如下:
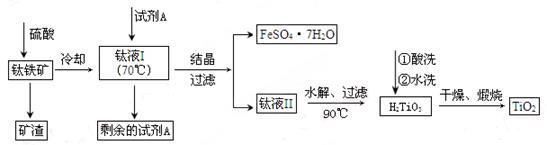
①试剂A为 。钛液Ⅰ需冷却至70℃左右,若温度过高会导致产品收率降低,原因是 。
②取少量酸洗后的H2TiO3,加入盐酸并振荡,滴加KSCN溶液后无明显现象,再加H2O2后出现微红色,说明H2TiO3中存在的杂质离子是 。这种H2TiO3即使用水充分洗涤,煅烧后获得的TiO2也会发黄,发黄的杂质是 (填化学式)。
实验室制取乙酸丁酯的实验装置有如下图所示两种装置供选用。其有关物质的物理性质如下表: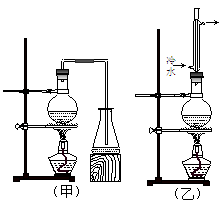
| | 乙酸 | 1-丁醇 | 乙酸丁酯 |
| 熔点(℃) | 16.6 | -89.5 | -73.5 |
| 沸点(℃) | 117.9 | 117 | 126.3 |
| 密度(g/cm3) | 1.05 | 0.81 | 0.88 |
| 水溶性 | 互溶 | 可溶(9g/100g水) | 微溶 |
(1)制取乙酸丁酯的装置应选用 (填“甲”或“乙”)。不选另一种装置的理由是 。
(2)该实验生成物中除了主产物乙酸丁酯外,还可能生成的有机副产物有(写出结构简式): 、 。
(3)酯化反应是一个可逆反应,为提高1-丁醇的利用率,可采取的措施是 。
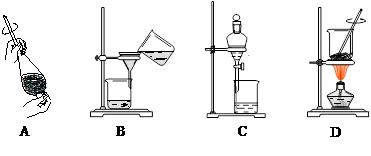
(4)从制备乙酸丁酯所得的混合物中分离、提纯乙酸丁酯时,需要经过多步操作,下列图示的操作中,肯定需要的化学操作是 (选填答案编号)。
(5)有机物的分离操作中,经常需要使用分液漏斗等仪器。使用分液漏斗前必须 ;某同学在进行分液操作时,若发现液体流不下来,其可能原因除分液漏斗活塞堵塞外,还可能 。
已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂;烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20%KSCN、0.1 mol·L-1 NaOH、6 mol·L-1 NaOH、0.1 mol·L-1 HCl、蒸馏水。
必要时可参考:
| 沉淀物 | 开始沉淀时的pH | 沉淀完全时的pH |
| Mg(OH)2 | 9.6 | 11.1 |
| Fe(OH)3 | 2.7 | 3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| …… | |
K3[Fe(C2O4)3]·3H2O [三草酸合铁(Ⅲ)酸钾晶体]易溶于水,难溶于乙醇,可作为有机反应的催化剂。实验室可用废铁屑等物质为原料制备,并测定产品的纯度。相关反应的化学方程式为:Fe + H2SO4 =FeSO4 + H2↑ FeSO4+H2C2O4+2H2O=FeC2O4·2H2O↓+H2SO4
2FeC2O4·2H2O+H2O2+H2C2O4+3K2C2O4=2K3[Fe(C2O4)3]+6H2O
回答下列问题:
(1)使用废铁屑前,往往将其在1.0mol.L-1Na2CO3溶液中浸泡数分钟,其目的是 。然后使用 (填写操作名称)分离并洗涤铁屑。
(2)析出的K3[Fe(C2O4)3]·3H2O晶体可通过如下图所示装置通过减压过滤与母液分离。下列关于减压过滤的操作正确的是 。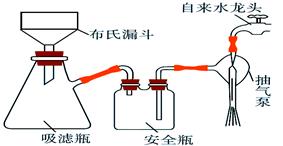
| A.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸 |
| B.放入滤纸后,直接用倾析法转移溶液和沉淀,再打开水龙头抽滤 |
| C.洗涤晶体时,先关闭水龙头,用蒸馏水缓慢淋洗,再打开水龙头抽滤 |
| D.抽滤完毕时,应先断开抽气泵和吸滤瓶之间的橡皮管,以防倒吸 |
(4)某同学称取2.000g产品,经预处理后配制成100mL溶液,移取25.00mL溶液于锥形瓶中,使用0.03000 mol·L-1KMnO4标准溶液滴定,消耗标准溶液10.00mL。
①实际进行滴定时,往往使用酸化的KMnO4标准溶液,写出该滴定反应的离子方程式 。
②判断到达滴定终点的现象是 。
③该产品的纯度为 ﹪(保留四位有效数字)。
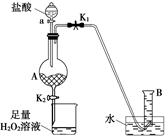
为了探究AgNO3的热稳定性,某化学兴趣小组设计了如下实验。用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。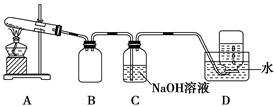
(1)装置B的作用是________。
(2)经小组讨论并验证该无色气体为O2,其验证方法是________________________________________。
(3)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是______(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有______。