题目内容
2-苯基-2-丁醇是重要的有机合成中间体,以溴苯为原料合成该中间体的反应原理如下:
【实验装置】

装置Ⅰ 装置Ⅱ
【实验步骤】
步骤1:将镁条置于装置Ⅰ的三颈烧瓶中,加入100 mL乙醚(ρ=0.71g·cm-3),在冷却条件下缓缓滴入溴苯,微热并加入一小块碘引发反应①。
步骤2:滴加14.2 mL丁酮和30 mL乙醚混合物,发生反应②;滴加入20%的NH4Cl水溶液,发生反应③。
步骤3:分出油层,用水洗涤至中性,用无水CaCl2干燥。
步骤4:用装置Ⅱ先蒸出乙醚,再蒸馏出产品。
⑴步骤1中加入碘的作用是 。
⑵装置Ⅰ中滴加液体所用的仪器的名称是 ,反应②需将三颈烧瓶置于冰水中,且逐滴加入丁酮和乙醚,其目的是 。
⑶步骤三中分离出油层的具体实验操作是 。
⑷装置Ⅱ采用的是减压蒸馏,实验时需将吸滤瓶需连接 ;采用这种蒸馏方式的原因是 。
⑴做催化剂
⑵恒压漏斗 该反应放热,防止反应过于剧烈
⑶将混合液置于分液漏斗中,先放出下层液体于烧杯中,再将上层液体从上口倒入另一烧杯中
⑷抽气泵 降低2-苯基-2-丁醇的沸点,防止温度过高发生分解
解析试题分析:(1)加入一小块碘“引发”反应,碘为催化剂;(2)置于冰水中温度低,逐滴加入控制反应速率,故防止反应速率过快;(3)分液分离油层,将混合液置于分液漏斗中,先放出下层液体于烧杯中,再将上层液体从上口倒入另一烧杯中;(4)减压蒸馏能降低沸腾时温度,防止温度过高引起物质分解等问题。
考点:考查实验化学有关问题。

 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案已知某酸性土壤浸取液中除Fe3+外,还含有一定量Mg2+和Al3+。请设计合理实验检验该浸取液中的Mg2+、Al3+。
限选实验用品与试剂:烧杯、试管、玻璃棒、滴管、玻璃片、pH试纸;浸取液、20% KSCN、0.1 mol·L-1NaOH、6 mol·L-1NaOH、0.1 mol·L-1HCl、蒸馏水。
必要时可参考:
| 沉淀物 | 开始沉淀时的pH | 沉淀完全时的pH |
| Mg(OH)2 | 9.6 | 11.1 |
| Fe(OH)3 | 2.7 | 3.7 |
根据你设计的实验方案,叙述实验操作、预期现象和结论。(测定溶液pH的具体操作可不写)
| 实验操作 | 预期现象和结论 |
| 步骤1: | |
| 步骤2: | |
| 步骤3: | |
| …… | |
实验室用硫酸铵、硫酸和废铁屑制备硫酸亚铁铵晶体的方法如下:
步骤1:将废铁屑依次用热的碳酸钠溶液、蒸馏水洗涤。
步骤2:向盛有洁净铁屑的烧杯中加入稀H2SO4溶液,水浴加热,使铁屑与稀硫酸反应至基本不再冒出气泡为止。趋热过滤。
步骤3:向滤液中加入一定量(NH4)2SO4固体。
硫酸亚铁晶体、硫酸铵、硫酸亚铁铵晶体的溶解度(g/100 g H2O)
| 温度物理溶解度 | 0 ℃ | 10 ℃ | 20 ℃ | 30 ℃ | 40 ℃ | 50 ℃ | 60 ℃ |
| FeSO4·7H2O | 15.6 | 20.5 | 26.5 | 32.9 | 40.2 | 48.6 | - |
| (NH4)2SO4 | 70.6 | 73.0 | 75.4 | 78.0 | 81.0 | - | 88.0 |
| (NH4)2SO4·FeSO4·6H2O | 12.5 | 17.2 | 21.0 | 28.1 | 33.0 | 40.0 | 44.6 |
(1)步骤2中控制生成的硫酸亚铁中不含硫酸铁的方法是______________。
(2)在0~60 ℃内,从硫酸亚铁和硫酸铵的混合溶液中可获得硫酸亚铁铵晶体的原因是_______________________________________________________。
(3)为了从步骤3所得溶液中获得硫酸亚铁铵晶体,操作是___________________________。
(4)测定硫酸亚铁铵晶体中Fe2+含量的步骤如下:
步骤1:准确称取a g(约为0.5 g)硫酸亚铁铵晶体样品,并配制成100 mL溶液。
步骤2:准确移取25.00 mL硫酸亚铁铵溶液于250 mL锥形瓶中。
步骤3:立即用浓度约为0.1 mol·L-1 KMnO4溶液滴定至溶液呈稳定的粉红色,即为滴定终点。
步骤4:将实验步骤1~3重复2次。
①步骤1中配制100 mL溶液需要的玻璃仪器是___________________________________;
②为获得样品中Fe2+的含量,还需补充的实验是_________________________________。



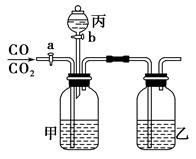

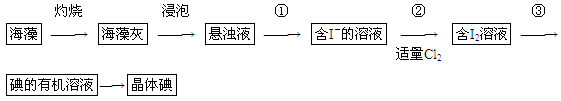 (1)实验操作③的名称是________,所用主要仪器名称为________。
(1)实验操作③的名称是________,所用主要仪器名称为________。
