题目内容
【题目】为探索工业含铝、铁、铜合金废料的再利用,某同学设计的回收利用方案如下:
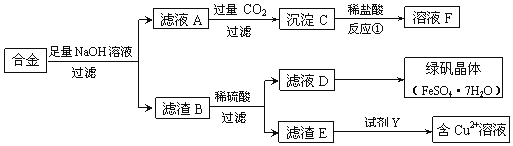
(1)合金与足量氢氧化钠溶液反应的离子方程式是______。
(2)若D中含有Fe3+,除去Fe3+的常用试剂是______。
(3)若要从滤液D中得到绿矾晶体,必须进行的实验操作步骤:______、______、过滤、洗涤、自然干燥。
(4)若由滤渣E得到含Cu2+的溶液,试剂Y选用稀硝酸,则化学方程式为:______。
【答案】2Al+2OH-+2H2O=2AlO2-+3H2↑ 铁粉 蒸发浓缩 冷却结晶 3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
【解析】
铁、铜均不与NaOH反应,由流程可知,合金与足量NaOH反应后过滤得到的滤渣B为Fe、Cu,滤液A含NaOH、NaAlO2,滤液A与足量二氧化碳反应生成沉淀C为Al(OH)3,C与盐酸反应生成F为氯化铝;Fe与稀硫酸反应,而Cu不能,则滤渣B与稀硫酸反应后过滤得到滤渣E为Cu,滤液D中含FeSO4,蒸发浓缩、冷却结晶可得到绿矾晶体,Cu与硝酸反应生成硝酸铜,据此解答。
(1)合金废料含铝、铁、铜,其中只有铝与足量氢氧化钠溶液反应,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)若D中含有Fe3+,除去Fe3+的常用试剂是铁粉,铁与Fe3+反应生成亚铁离子,不引入杂质;
(3)因为绿矾晶体是结晶水合物,所以要从滤液D中得到绿矾晶体,不能直接蒸干,必须进行的实验操作步骤是:蒸发浓缩、冷却结晶、过滤、洗涤、自然干燥;
(4)由滤渣E得到含Cu2+的溶液,试剂Y选用稀硝酸,则化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目