题目内容
【题目】如图所示,下列说法正确的是
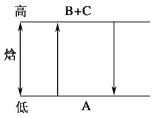
A. A―→B+C ΔH>0,B+C―→A ΔH<0
B. A―→B+C ΔH<0
C. A具有的能量高于B和C具有的能量的总和
D. A―→B+C和B+C―→A两个反应吸收或放出的能量不等
【答案】A
【解析】
根据能量守恒可知,正、逆两个过程中的能量变化的数值相等,只是一个过程吸热,另一个过程放热;A的能量低,而B和C的总能量高,则反应A→B+C应为吸热反应,ΔH>0;A具有的能量小于B和C具有的能量的总和;结合以上分析解答。
A.A→B+C是能量升高的反应,属于吸热反应,△H>0,则B+C→A,属于放热反应,ΔH<0,故A正确;
B.A→B+C是能量升高的反应,属于吸热反应,△H>0,故B错误;
C. A→B+C是能量升高的反应,属于吸热反应,△H>0,所以A具有的能量低于B和C具有的能量和,故C错误;
D. A→B+C与B+C→A属于同一反应的正逆两个方向的反应,两个反应吸收和放出的热量相等;故D错误;
综上所述,本题选A。

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案
相关题目