题目内容
【题目】碘在医药、照相、橡胶、染料、气象等许多领域都具有广泛的用途,海洋中虽然含碘的浓度相当小,每升海水中平均含碘0.06mg,但海洋里碘的总储量仍很惊人——9.3×1010t,比陆地上要多得多。一般生长在海底的海带含碘0.3%~0.5%,有的可达1%,比海水中碘的浓度高出十几万倍!海藻中含有丰富的碘元素(以I-形式存在)。实验室提取碘的流程如下:
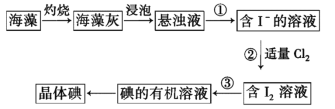
(1)实验操作①的名称是_________,实验操作③所用主要仪器名称为____________,实验②发生的离子反应方程式为 ___________________。
(2)提取碘的过程中,可供选择的有机试剂是___________(填序号)。
A.四氯化碳(沸点77℃) B.酒精(沸点78℃) C.苯(沸点80℃)
(3)在操作②中,溶液中生成少量ICl,为消耗此杂质,使碘全部游离出来,应加入适量_________(填序号)溶液,反应的离子方程式为___________。
A.KIO3 B.HClO C.Br2 D.KI
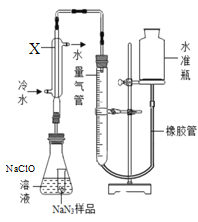
(4)为使从含碘有机溶液中提取碘并回收溶剂,采用水浴加热蒸馏(如图所示)。请指出图中实验装置除未加沸石外的错误之处(有处填几处,下列空白可不填满,也可补充)。
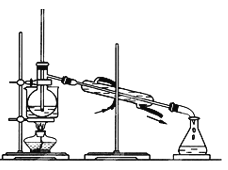
①____________
②____________
③____________
【答案】过滤 分液漏斗 Cl2+2I-=2Cl-+I2 AC D ICl+I-=Cl-+I2 缺石棉网 温度计插到了液体中 冷凝管进出水方向颠倒
【解析】
海藻提取碘的流程是:海藻在坩埚中灼烧,向海藻灰中加水,得到悬浊液,过滤得到含I-的溶液,通入氯气把I-氧化为I2,用有机溶液萃取I2水中的I2,蒸馏得到晶体I2;
(1)实验操作①是分离含I-的溶液和海藻灰渣,属于固液分离,名称是过滤,实验操作③是用有机溶液萃取I2水中的I2,所用主要仪器是分液漏斗,实验②是通氯气把I-氧化为I2,发生的离子反应方程式为Cl2+2I-=2Cl-+I2;
(2) 用有机溶液萃取I2水中的I2,酒精与水互溶,不能用酒精作萃取剂,提取碘的过程中,选择的有机试剂是四氯化碳、苯,选AC;
(3) 要实现转化ICl→I2,应该加入还原剂,且不引进杂质离子,可以选择还原性较强的碘离子;ICl中I的化合价为+1,ICl发生还原反应生成I2,ICl+KI= I2+KCl,所以为使碘全部游离出来,应加入适量KI溶液,选D;该反应的离子方程式为ICl+I-=Cl-+I2;
(4)蒸馏操作时,温度计液泡应在蒸馏烧瓶的支管口处,错误1是温度计插到了液体中;冷凝管中的冷凝水应“低进高出”,错误2是冷凝管进出水方向颠倒;给烧杯加热应垫上石棉网,错误3是缺石棉网。

 阅读快车系列答案
阅读快车系列答案