题目内容
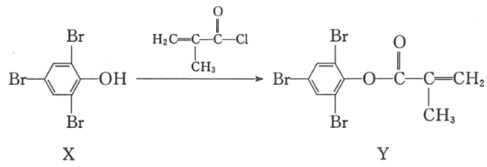
【题目】亚硝酰氯(NOC1)的沸点为-5.5℃,具有刺鼻恶臭味,在潮湿空气中易水解,溶于浓硫酸,是有机合成中的重要试剂。某同学用如图装置,由NO与干燥纯净的Cl2反应制备NOCl。
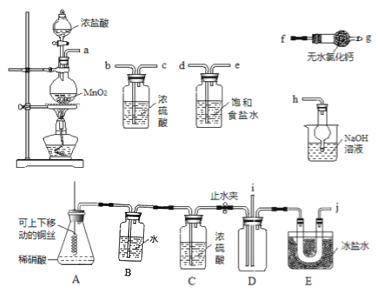
己知:①Cl2沸点为-34.6℃,NO2Cl沸点为-15℃②2NO+Cl2=2NOC1![]() 2NO2+Cl2=2NO2Cl
2NO2+Cl2=2NO2Cl
回答下列问题:
(1)铜与稀硝酸反应的化学方程式为______。
(2)图中实验装置的连接顺序为:a→_______。
(3)实验时,先制取氯气使充满除A、B、C外的整套装置,目的是______;装置中充满氯气后,下—步是制取NO,具体操作是______;E中冰盐水的温度可低至-22℃,其作用是______。
(4)该同学的实验设计可能的不足之处是______(答出一条即可)。
(5)若无C装置,则不利于NOCl的制备,主要原因是______(用化学方程式表示)。
【答案】3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O d、e—b、c—i、j—f、g—h 排出装置中的空气中 打开止水夹,并将铜丝插入稀硝酸 将NOCl冷凝为液态 B、C上部的空气会将NO氧化(或E中制得的NOCl产品中可能混有少量NO2Cl) NOCl+H2O=HNO2+HCl
【解析】
由干燥纯净的氯气与一氧化氮在常温常压下合成NOCl。根据装置图,由二氧化锰与浓盐酸制备氯气,制得的氯气中混有氯化氢和水蒸气,需要用饱和食盐水吸收氯化氢气体,用浓硫酸干燥,由A用铜和稀硝酸反应制备NO,制得的NO中可能混有其他氮氧化合物,故B用水净化NO,装置C用浓硫酸干燥,将氯气和NO干燥后在装置D中发生反应,在冰盐水冷却的E装置中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,可以用氢氧化钠溶液吸收尾气;NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个干燥装置,据此分析解答。
(1)铜与稀硝酸制备NO,化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,故答案为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O;
(2)由二氧化锰与浓盐酸制备氯气,制得的氯气中混有氯化氢和水蒸气,需要首先用饱和食盐水吸收氯化氢气体,再用浓硫酸干燥,则a连接d、e-b、c,将干燥后的氯气和NO在装置D中发生反应,在冰盐水冷却的E中冷凝收集NOCl,氯气、NO以及NOCl均不能排放到空气中,用氢氧化钠溶液吸收,NOCl遇水易水解,故在收集装置和尾气处理装置之间需加一个干燥装置,故c-i、j-f、g-h,故答案为:d、e-b、c-i、j-f、g-h;
(3)NO能够与空气中的氧气反应,需要排除装置中的空气,实验时,先制取氯气,使氯气充满除A、B、C外的整套装置,装置中充满氯气后,打开止水夹,并将铜丝插入稀硝酸中,制备NO,E中冰盐水将NOCl冷凝为液态,便于收集;故答案为:排出装置中的空气;打开止水夹,并将铜丝插入稀硝酸中;将NOCl冷凝为液态;
(4)NO遇空气中的氧气被氧化,B、C上部的空气会将NO氧化,不利于反应,故答案为:B、C上部的空气会将NO氧化;
(5)若无C装置,NOCl与水蒸气发生水解反应:NOCl+H2O=HNO2+HCl,故答案为:NOCl+H2O=HNO2+HCl。

【题目】某地菱锰矿的主要成分为MnCO3,还含有少量的FeCO3、CaCO3、Al2O3等杂质。工业上以菱锰矿为原料制备高纯度碳酸锰的流程如图所示:
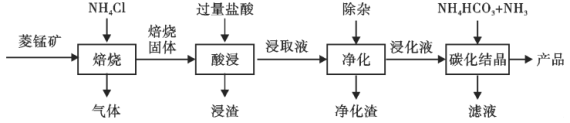
已知:MnCO3+2NH4Cl=MnCl2+CO2↑+2NH3↑+H2O.
相关金属离子[c0(Mn+)=0.1mol·L-1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 |
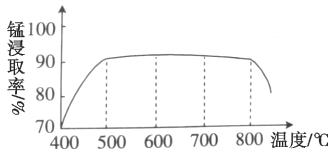
(1)焙烧时温度对锰浸取率的影响如图。焙烧时适宜的温度为___________左右;800℃以上锰的浸取率偏低,可能的原因是___________。
(2)净化包含三步:①加入少量MnO2,添加少量MnO2的作用是____________。发生反应的离子方程式为___________。
②加氨水调pH,溶液的pH范围应调节为___________~8.1之间。生成的沉淀主要是___________。
③加入MnF2,沉淀除去Ca2+,若溶液酸度过高,Ca2+沉淀不完全,原因是___________。
(3)碳化结晶中生成MnCO3的离子方程式为____________。