题目内容
【题目】将Cu投入足量的FeCl3的水溶液中,两者发生反应的化学方程式如下:2FeCl3+Cu===2FeCl2+
CuCl2。
(1)请用双线桥法标出电子转移的方向和数目___________________________。
(2)当有0.3 mol电子发生转移时,发生反应的Cu的质量为_________。
(3)请将以上反应改写为离子方程式___________________。
(4)配平下列方程式: FeCl2+ H2O2+ HCl=== FeCl3+ H2O。
(5)高锰酸钾和氢溴酸溶液可以发生下列反应:2KMnO4+16HBr===5Br2+2MnBr2+2KBr+8H2O,若消耗15.8 g氧化剂KMnO4,则被氧化的还原剂的质量是_______。
【答案】(1)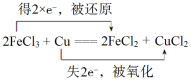 (3分)
(3分)
(2)9.6 g(2分)
(3)2Fe3++Cu===2Fe2++Cu2+(3分)
(4)2 1 2 2 2(共2分)
(5)40.5 g(3分)
【解析】(1)FeCl3中Fe的化合价降低,FeCl3作氧化剂,还原产物是FeCl2,Cu的化合价升高,Cu作还原剂,CuCl2作氧化产物,用双线桥表示电子转移方向和数目是 。
。
(2)本题考查氧化还原反应的计算,转移2 mol电子时消耗铜的质量为64 g,因此转移0.3 mol电子,消耗Cu的质量为0.3×64/2 g=9.6 g。
(3)本题考查离子方程式的书写,FeCl3、FeCl2、CuCl2都是可溶性的盐,完全电离,因此离子反应方程式为Cu+2Fe3+===Cu2++2Fe2+。
(4)本题考查氧化还原反应方程式的配平,FeCl2中Fe的化合价由+2价→+3价,化合价升高1价,H2O2中O的化合价由1价→2价,化合价整体降低2价,最小公倍数为2,再根据原子守恒配平其他,可得2FeCl2+H2O2+2HCl===2FeCl3+2H2O。
(5)根据得失电子守恒进行计算,15.8 g×5/158 g·mol1=n(HBr)×1,解得被氧化的n(HBr)=0.5 mol,m(HBr)=0.5×81 g=40.5 g。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案



