题目内容
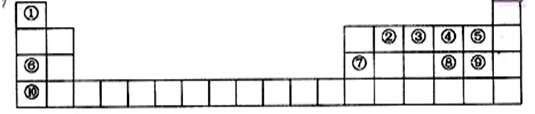
(1)前三周期元素中第一电离能最小的是___________ (填元素符号),其基态原子的电子排布式为______________________。第二周期非金属元素形成的氢化物中化学键极性最大的是__________(填分子式)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
(3)电负性的大小:C___________O,键能的大小:HBr___________HI。(填“>”、“=”或“<”)
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
| 代号 | 物质 | 结构简式 | 水中溶解度/g (25℃) | 熔点/℃ | 沸点/℃ |
| A | 邻—硝基苯酚 | 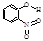 | 0.2 | 45 | 100 |
| B | 对—硝基苯酚 | 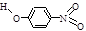 | 1.7 | 114 | 295 |
(1)Na [Ne]3s1 HF (2)B ;(3)< >
(1)前三周期元素中第一电离能最小的是原子半径最大,最容易失电子的Na, 其基态原子的电子排布式为[Ne]3s1或1s22s22p63s1, 第二周期非金属元素形成的氢化物中化学键极性最大的是本周期原子半径最小的F与H形成的HF.
(2)
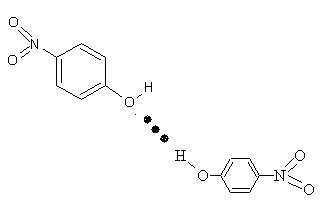 对—硝基苯酚分子之间形成如图所示的分子间氢键
对—硝基苯酚分子之间形成如图所示的分子间氢键(3)电负性的大小:C < O, 同周期从左到右电负性变大;键能的大小:HBr>HI,I原子半径大,与H之间作用力小,键能小。

练习册系列答案
 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案
相关题目