题目内容
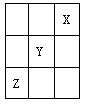
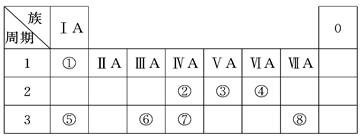
X、Y、Z、W都是短周期元素,核电荷数依次增大。X和Z同主族,Y、Z、W同周期,Y的原子半径是所处周期中最大的, W的最高价氧化物所对应的水化物是强酸,X与W的核电荷数之比为3∶8。据此判断下列说法正确的是
| A.Y是第三周期ⅦA族元素 | B.Z一定是金属元素 |
| C.非金属性:W﹥X | D.Y与W的最高正价之和为8 |
C
X与W的核电荷数之比为3∶8,所以X可能是3号元素,W是8号元素。或X为6号元素,W为16号元素。因为W的最高价氧化物所对应的水化物是强酸,所以W为16号元素S,X为6号元素C,X和Z同主族,所以Z为Si。因为Y、Z(硅)、W(硫)同周期,且Y的原子半径是所处周期中最大的,所以Y为钠,为第三周期IA族,A错。Z为Si,非金属元素,B错。Y(钠)与W(硫)的最高正价之和为7,D错。硫酸酸性强于碳酸,所以非金属性:W(硫)﹥X(碳),C对。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目