题目内容
【题目】海带中所含碘元素以碘离子(I-)的形式存在,经常食用海带可以防治甲状腺肿大。某同学设计实验从海带中提取碘,有如下操作:①滤液中滴加稀硫酸和双氧水;②在海带中加入少量酒精,使其燃烧为灰烬,在灰烬中加水搅拌;③加四氯化碳并振荡;④过滤;⑤分液;⑥蒸馏。下列说法不正确的是( )
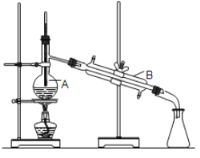
A.实验的合理操作顺序是②④①③⑤⑥
B.步骤②、④中都需要用到玻璃棒
C.步骤①中双氧水表现氧化性
D.通常用如图所示装置蒸馏,产品中易混有高沸点杂质
【答案】D
【解析】
按分离提纯顺序,先将海带烧成灰,向灰中加水搅拌,过滤除去不溶物,取滤液滴加稀硫酸和双氧水,双氧水将溶液中的碘离子氧化成碘单质,然后利用有机溶剂进行萃取,分液后利用沸点不同将碘和有机溶剂蒸馏分离。
A.根据分析可知,实验的合理操作顺序是②④①③⑤⑥,故A正确;
B.步骤②为加速溶解,需要用玻璃棒进行搅拌,④为过滤需要用到玻璃棒进行引流,故B正确;
C.步骤①中双氧水将碘离子氧化成碘单质,双氧水为氧化剂,表现氧化性,故C正确;
D.如图所示装置的温度计的水银球放置位置过低,所以装置错误,用该进行蒸馏时,会导致产品中易混有低沸点杂质,故D错误;
综上所述,答案为D。

【题目】下列说法正确的是(________)
A.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
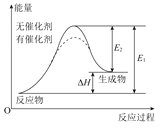
C.由“C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1”可知,金刚石比石墨稳定
D.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
E.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
F.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂可以是浓溶液
G.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3
H.把铝条放入盛有过量稀盐酸的试管中,加入Na2SO4溶液不影响氢气产生速率
I.对于可逆反应,反应进行的净速率是正、逆反应速率之差
J.对于可逆反应,正、逆反应速率的比值是恒定的
K.探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合
L.已知:
共价键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g)的ΔH为-384kJ·mol-1
(g)的ΔH为-384kJ·mol-1