题目内容
下列关于电解质溶液的叙述正确的是
| A.常温下,同浓度的Na2CO3与NaHCO3溶液相比,Na2CO3溶液的pH大 |
B.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)>c(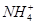 )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| C.中和pH与体积均相同的盐酸和醋酸,消耗NaOH溶液的物质的量相同 |
| D.将pH=4的盐酸稀释后,溶液中所有离子的浓度均降低 |
A
选项A,Na2CO3的水解能力大于NaHCO3的水解能力,常温下,同浓度的Na2CO3溶液的pH大于NaHCO3溶液的。选项B,根据电荷守恒可得c(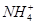 )+c(H+)=c(OH-)+c(Cl-),因c(H+)=c(OH-),所以c(
)+c(H+)=c(OH-)+c(Cl-),因c(H+)=c(OH-),所以c(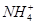 )=c(Cl-),故有c(
)=c(Cl-),故有c(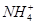 )=c(Cl-)>c(H+)=c(OH-)。选项C,pH相同的盐酸、CH3COOH溶液相比,CH3COOH的物质的量浓度远远大于HCl的物质的量浓度,所以中和等体积、等pH的盐酸、CH3COOH溶液时,CH3COOH消耗NaOH的物质的量多。选项D,稀释盐酸时,c(H+)下降,但c(OH-)上升。
)=c(Cl-)>c(H+)=c(OH-)。选项C,pH相同的盐酸、CH3COOH溶液相比,CH3COOH的物质的量浓度远远大于HCl的物质的量浓度,所以中和等体积、等pH的盐酸、CH3COOH溶液时,CH3COOH消耗NaOH的物质的量多。选项D,稀释盐酸时,c(H+)下降,但c(OH-)上升。
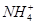 )+c(H+)=c(OH-)+c(Cl-),因c(H+)=c(OH-),所以c(
)+c(H+)=c(OH-)+c(Cl-),因c(H+)=c(OH-),所以c(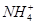 )=c(Cl-),故有c(
)=c(Cl-),故有c(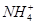 )=c(Cl-)>c(H+)=c(OH-)。选项C,pH相同的盐酸、CH3COOH溶液相比,CH3COOH的物质的量浓度远远大于HCl的物质的量浓度,所以中和等体积、等pH的盐酸、CH3COOH溶液时,CH3COOH消耗NaOH的物质的量多。选项D,稀释盐酸时,c(H+)下降,但c(OH-)上升。
)=c(Cl-)>c(H+)=c(OH-)。选项C,pH相同的盐酸、CH3COOH溶液相比,CH3COOH的物质的量浓度远远大于HCl的物质的量浓度,所以中和等体积、等pH的盐酸、CH3COOH溶液时,CH3COOH消耗NaOH的物质的量多。选项D,稀释盐酸时,c(H+)下降,但c(OH-)上升。
练习册系列答案
 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案
相关题目
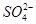 、
、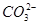
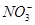 、Cl-
、Cl-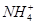 、I-、SCN-
、I-、SCN-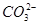 、
、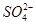 ,现取两份100 mL溶液进行如下实验:
,现取两份100 mL溶液进行如下实验: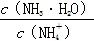 值变小
值变小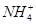 )>c(Cl-)>c(H+)>c(OH-)
)>c(Cl-)>c(H+)>c(OH-)