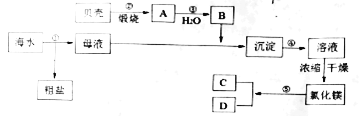
题目内容
【题目】(1)有以下六种物质:①乙醇 ②![]() 溶液 ③
溶液 ③![]() 固体 ④液态氯化氢 ⑤纯
固体 ④液态氯化氢 ⑤纯![]() ⑥石墨,上述状态下的物质中,能导电的有___________(填序号,下同),属于强电解质的有___________。
⑥石墨,上述状态下的物质中,能导电的有___________(填序号,下同),属于强电解质的有___________。
(2)![]() 和浓盐酸常用于实验室制氯气,请用双线桥法标出电子转移方向和数目。________________
和浓盐酸常用于实验室制氯气,请用双线桥法标出电子转移方向和数目。________________
(3)配平下列化学方程式,在横线上填写化学计量数。
_________![]() _________
_________![]() _________
_________![]() =_________
=_________![]() _________
_________![]() _________
_________![]()
(4)已知反应:![]() ,当反应生成2.40gBr2时,电子转移的数目为____________。
,当反应生成2.40gBr2时,电子转移的数目为____________。
【答案】②⑥ ③④  2 5 3 6 2 3 0.025 NA
2 5 3 6 2 3 0.025 NA
【解析】
(1)①乙醇不导电为非电解质 ②![]() 溶液可以导电但为混合物 ③
溶液可以导电但为混合物 ③![]() 固体不可以导电为强电解质 ④液态氯化氢不导电但为强电解质 ⑤纯
固体不可以导电为强电解质 ④液态氯化氢不导电但为强电解质 ⑤纯![]() 不导电但为弱电解质 ⑥石墨可以导电但为单质;
不导电但为弱电解质 ⑥石墨可以导电但为单质;
(2)反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
(3)根据元素化合价的变化配平得失电子,然后再依据元素守恒配平整个方程式;
(4)反应中NaBr中溴元素由-1价升高为0价,且只有溴离子化合价升高,化合价升高值=化合价降低值=转移电子数;
(1)根据分析可知能导电的有②⑥;属于强电解质的有③④;
(2)反应中Mn元素化合价降低,化合价由+4价降低到+2价,Cl元素化合价升高,由-1价升高到0价,氧化还原反应中得失电子数目相等,表现为化合价升降的总数相等,可表示为 ;
;
(3)反应中锰元素由+7价变为+2价,![]() 中硫元素由+4价变为+6价,所以
中硫元素由+4价变为+6价,所以![]() 和
和![]() 的系数比为2:5,得失电子守恒,再根据元素守恒可得方程式为
的系数比为2:5,得失电子守恒,再根据元素守恒可得方程式为![]() ;
;
(4)反应中NaBr中溴元素由-1价升高为0价,且只有溴离子化合价升高,根据方程式可知生成3mol溴单质时有5molNaBr参与反应,转移电子数为5NA,2.40gBr2的物质的量为![]() ,转移电子为0.015mol×
,转移电子为0.015mol×![]() =0.025mol,即0.025 NA。
=0.025mol,即0.025 NA。

 名校课堂系列答案
名校课堂系列答案