题目内容
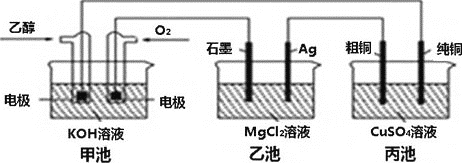
【题目】某种新型电池放电时的总反应方程式为:![]() ,装置如图。下列说法正确的是
,装置如图。下列说法正确的是![]()

A.放电过程中![]() 通过膜向正极移动
通过膜向正极移动
B.右侧的电极反应式为:![]()
C.若M为Al,则电池放电过程的负极反应式为:![]()
D.在![]() 空气电池中,为防止负极区沉积
空气电池中,为防止负极区沉积![]() ,可改用稀硫酸做电解质溶液
,可改用稀硫酸做电解质溶液
【答案】B
【解析】
已知新型电池放电时的总反应方程式为:4M+nO2+2nH2O═4M(OH)n,电池放电时正极上O2 转化为OH-,负极的M失电子转化为M(OH)n,正极电极反应式为O2+4e-+2H2O=4OH-,负极电极反应式为M-ne-+nOH-═M(OH)n,据此分析解答。
A.阳离子不能通过阴离子交换膜,所以Mn+不能通过膜,故A错误;
B.电池放电时正极上O2 转化为OH-,则右侧的电极反应式为:O2+4e-+2H2O=4OH-,故B正确;
C.若M为Al,Al失电子生成AlO2-,则电池放电过程的负极反应式为:Al-3e-+4OH-=AlO2-+2H2O,故C错误;
D.在Mg-空气电池中,改用稀硫酸做电解质溶液,Mg与稀硫酸接触直接反应,故D错误。
故选:B。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】某学生用0.1500moVL标准盐酸测定某未知浓度的NaOH溶液,其操作可分解为如下几步:
A.用蒸馏水洗净滴定管
B.用待测定的溶液润洗碱式滴定管
C.用碱式滴定管取NaOH溶液25.00mL,注入锥形瓶中,加入酚酞
D.另取锥形瓶,再重复操作2~3次
E.检查滴定管是否湍水
F.取下酸式滴定管用标准盐酸润洗后,将标准液注入酸式滴定管“0"刻度以上2~3cm处,再把酸式滴定管固定好,调节液面至0"刻度或“0"刻度以下
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
完成以下填空:
(1)滴定时正确操作的顺序是(用字母填写)____________________
(2)本实验中对滴定管的操作如下图所示,正确的是______________(填字母)。

(3)判断到达滴定终点的现象是________________________________________
滴定结果如下表所示:
滴定次数 | 待测液体积/mL | 标准溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 0.60 | 20.60 |
3 | 25.00 | 0.20 | 20.19 |
计算该NaOH溶液的物质的量浓度为_____________mol/L
(4)下列操作会导致测定结果偏高的是________
A.酸式滴定管在装液前未用标准盐酸润洗
B.滴定过程中,锥形瓶摇晃的太剧烈,锥形瓶内有液体溅出
C.酸式滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数