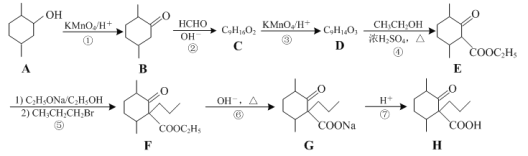
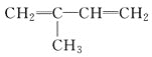题目内容
【题目】硫酸铁铵[(NH4)xFey(SO4)znH2O]是一种重要铁盐,实验室采用废铁屑来制备硫酸铁铵的流程如下:
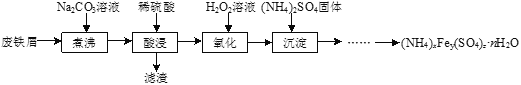
(1)将废铁屑和Na2CO3溶液混合煮沸可除去铁屑表面的油脂,原理是_____________。
(2)“氧化”过程需使用足量的H2O2,同时溶液要保持pH小于0.5,目的是__________。
(3)化学兴趣小组用如下方法测定硫酸铁铵晶体的化学式:
步骤1:准确称取样品28.92 g,溶于水配成100 mL溶液。
步骤2:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入适量稀硫酸,滴加过量的SnCl2溶液(Sn2+与Fe3+反应生成Sn4+和Fe2+),充分反应后除去过量的Sn2+。用0.1000molL-1的K2Cr2O7溶液滴定Fe2+,滴定至终点时消耗K2Cr2O7溶液25.00 mL。(滴定过程中Cr2O72-转化成Cr3+)
步骤3:准确量取25.00 mL步骤1所得溶液于锥形瓶中,加入过量的BaCl2溶液,将所得白色沉淀过滤、洗涤、干燥后称量,所得固体质量为6.99 g。
①排除装有K2Cr2O7溶液的滴定管尖嘴处气泡的方法是_________。
②通过计算确定该硫酸铁铵的化学式____________(写出计算过程)。
【答案】加热可以促进Na2CO3水解使溶液碱性增强,溶液碱性增强有利于油脂水解 将Fe2+完全转化为Fe3+,同时抑制Fe3+的水解 快速放液 NH4Fe(SO4)2·12H2O
【解析】
将废铁屑和Na2CO3溶液混合煮沸可除去铁屑表面的油脂,利用稀硫酸进行酸浸后除去滤渣,生成硫酸铁溶液,利用双氧水将溶液中的Fe2+氧化为Fe3+,加入硫酸铵固体使其沉淀,进一步处理得到硫酸铁铵[(NH4)xFey(SO4)znH2O],据此分析。
将废铁屑和Na2CO3溶液混合煮沸可除去铁屑表面的油脂,利用稀硫酸进行酸浸后除去滤渣,生成硫酸铁溶液,利用双氧水将溶液中的Fe2+氧化为Fe3+,加入硫酸铵固体使其沉淀,进一步处理得到硫酸铁铵[(NH4)xFey(SO4)znH2O]。
(1)将废铁屑和Na2CO3溶液混合煮沸可除去铁屑表面的油脂,原理是加热可以促进Na2CO3水解使溶液碱性增强,溶液碱性增强有利于油脂水解;
(2)“氧化”过程需使用足量的H2O2,同时溶液要保持pH小于0.5,目的是将Fe2+完全转化为Fe3+,同时抑制Fe3+的水解;
(3)①快速放液,可以排除装有K2Cr2O7溶液的滴定管尖嘴处气泡;
②n(Fe)=![]() =0.06mol,n(Fe3+)=0.06mol;
=0.06mol,n(Fe3+)=0.06mol;
n(BaSO4)=![]() = 0.03mol,则样品中n(SO42-)=0.12mol
= 0.03mol,则样品中n(SO42-)=0.12mol
由电荷守恒,得样品中n(NH4+)=0.06mol
由质量守恒,得样品中n(H2O)=![]() =0.72mol
=0.72mol
则,n(Fe3+):n(SO42-):n(NH4+) :n(H2O)= 0.06mol:0.12mol:0.06mol:0.72mol =1:2:1:12,
化学式为NH4Fe(SO4)2·12H2O。

【题目】工业上由MnS矿(还含少量FeCO3、MgO等)制备高纯硫酸锰,工艺如图所示:
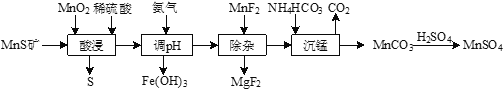
已知相关金属离子(浓度为0.1mol·L-1)形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Mg2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.8 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 3.2 | 10.9 |
(1)“酸浸”过程中,MnS(难溶)发生反应的离子方程式为_____________。
(2)“酸浸”时MnO2应过量,目的是____________和将Fe2+氧化为Fe3+。
(3)已知Ksp[Fe(OH)3]=4×10-38。常温下,当溶液的pH=2时,c(Fe3+)=______________mol·L-1。
(4)“除杂”时若溶液pH过低,Mg2+沉淀不完全,原因是_______________。
(5)“沉锰”反应的化学方程式为_____________。

(6)用MnO2悬浊液吸收SO2也可以制取MnSO4。将SO2和空气的混合气通入MnO2悬浊液,测得吸收液中Mn2+、SO42-的浓度随反应时间t变化如图。导致Mn2+、SO42-浓度变化产生明显差异的原因是_____________。