题目内容
【题目】工业上由MnS矿(还含少量FeCO3、MgO等)制备高纯硫酸锰,工艺如图所示:

已知相关金属离子(浓度为0.1mol·L-1)形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Mg2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.8 | 8.9 |
沉淀完全的pH | 10.1 | 8.3 | 3.2 | 10.9 |
(1)“酸浸”过程中,MnS(难溶)发生反应的离子方程式为_____________。
(2)“酸浸”时MnO2应过量,目的是____________和将Fe2+氧化为Fe3+。
(3)已知Ksp[Fe(OH)3]=4×10-38。常温下,当溶液的pH=2时,c(Fe3+)=______________mol·L-1。
(4)“除杂”时若溶液pH过低,Mg2+沉淀不完全,原因是_______________。
(5)“沉锰”反应的化学方程式为_____________。
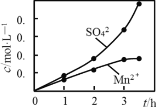
(6)用MnO2悬浊液吸收SO2也可以制取MnSO4。将SO2和空气的混合气通入MnO2悬浊液,测得吸收液中Mn2+、SO42-的浓度随反应时间t变化如图。导致Mn2+、SO42-浓度变化产生明显差异的原因是_____________。
【答案】MnS+MnO2+4H+=S+2Mn2++2H2O 提高MnS的转化率 4×10-2 H+与F-/反应生成弱酸HF 2NH4HCO3+MnSO4=MnCO3↓+(NH4)2SO4+CO2↑+H2O Mn2+催化O2与H2SO3反应生成H2SO4
【解析】
(1)“酸浸”过程中,MnS与MnO2反应生成硫单质,硫酸锰和水;
(2)根据金属沉淀的pH进行分析;
(3) 根据Ksp[Fe(OH)3]= c(Fe3+)×c3(OH-)进行计算;
(4) “除杂”时若溶液pH过低,H+与F-反应生成弱酸HF;
(5) “沉锰”时,碳酸氢铵与硫酸锰反应生成碳酸锰、硫酸铵、二氧化碳和水;
(6) Mn2+催化O2与H2SO3反应生成H2SO4。
(1)“酸浸”过程中,MnS与MnO2反应生成硫单质,硫酸锰和水,反应的离子方程式为MnS+MnO2+4H+=S+2Mn2++2H2O;
(2)为提高MnS的转化率和将Fe2+氧化为Fe3+,“酸浸”时MnO2应过量;
(3)常温下,当溶液的pH=2时,c(H+)=10-2mol·L-1,c(OH-)= =10-12mol·L-1,Ksp[Fe(OH)3]= c(Fe3+)×c3(OH-)=c(Fe3+)×(10-12mol·L-1)3=4×10-38,解得c(Fe3+)=4×10-2mol·L-1;
=10-12mol·L-1,Ksp[Fe(OH)3]= c(Fe3+)×c3(OH-)=c(Fe3+)×(10-12mol·L-1)3=4×10-38,解得c(Fe3+)=4×10-2mol·L-1;
(4)“除杂”时若溶液pH过低,H+与F-反应生成弱酸HF ,Mg2+沉淀不完全;
(5)根据流程可知,“沉锰”时,碳酸氢铵与硫酸锰反应生成碳酸锰、硫酸铵、二氧化碳和水,反应的化学方程式为2NH4HCO3+MnSO4=MnCO3↓+(NH4)2SO4+CO2↑+H2O;
(6)将SO2和空气的混合气通入MnO2悬浊液,Mn2+催化O2与H2SO3反应生成H2SO4,导致Mn2+、SO42-浓度迅速增大。

【题目】(1)常温下,向20mL0.05mol·L-1的某稀酸H2B溶液中滴入0.1mol·L-1氨水,溶液中由水电离出氢离子浓度随滴入氨水体积变化如图。回答下列问题

①NaHB溶液呈_______(填“酸性”“碱性”或“中性”)
②A、D、E三点溶液的pH由大到小为:_______
③F点溶液c(NH4+)_______2c(B2-)(填“>”“<”或“=”)
(2)某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究。
(查阅资料)25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Fe(OH)3]=4.0×10-38
(实验探究)向2支均盛有1mL0.1mol/LMgCl2溶液的试管中分别加入2滴2mol/LNaOH溶液,制得等量Mg(OH)2沉淀。
①分别向两支试管中加入不同试剂,请填写下表中的实验现象(用下列选项中字母代号填写)
试管编号 | 加入试剂 | 实验现象 |
Ⅰ | 2滴0.1mol/LFeCl3溶液 | _______ |
Ⅱ | 4mL2mol/LNH4Cl溶液 | _______ |
A 白色沉淀转化为红褐色沉淀 B 白色沉淀不发生改变
C 红褐色沉淀转化为白色沉淀 D 白色沉淀溶解,得无色溶液
②同学们猜想实验Ⅱ中沉淀溶解的主要原因有两种:
猜想1:NH4+结合Mg(OH)2电离出的OH-,使Mg(OH)2的沉淀溶解平衡正向移动。猜想2:_______。
(3)为验证猜想,同学们取少量相同质量的氢氧化镁固体盛放在两支试管中,一支试管中加入醋酸铵溶液(pH=7),另一支试管中加入NH4Cl和氨水混合液(pH=8),两者沉淀均溶解。该实验证明正确的是_______(填“猜想1”或“猜想2”)。