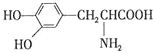
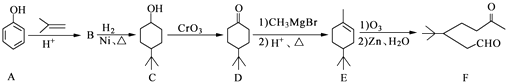
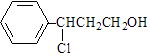题目内容
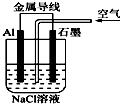
【题目】金属(M)﹣空气电池(如图)具有原料易得,能量密度高等优点,有望成为新能源汽车和移动设备的电源,该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH)n , 已知:电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,下列说法不正确的是( ) 
A.采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面
B.比较Mg,Al,Zn三种金属﹣空气电池,Al﹣空气电池的理论比能量最高
C.M﹣空气电池放电过程的正极反应式:4M++nO2+2nH2O+4ne﹣=4M(OH)n
D.在Mg﹣空气电池中,为防止负极区沉积Mg(OH)2 , 宜采用中性电解质及阳离子交换膜
【答案】C
【解析】解:A.反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,故A正确;B.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多,假设质量都是1g时,这三种金属转移电子物质的量分别为 ![]() mol、
mol、 ![]() ×3=
×3= ![]() mol、
mol、 ![]() ×2=
×2= ![]() mol,所以Al﹣空气电池的理论比能量最高,故B正确;
mol,所以Al﹣空气电池的理论比能量最高,故B正确;
C.正极上氧气得电子和水反应生成OH﹣ , 因为是阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e﹣=4OH﹣ , 故C错误;
D.负极上Mg失电子生成Mg2+ , 为防止负极区沉积Mg(OH)2 , 则阴极区溶液不能含有大量OH﹣ , 所以宜采用中性电解质及阳离子交换膜,故D正确;
故选C.

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】目前,氯的氧化物有Cl2O、ClO2、Cl2O7等.其中ClO2与Cl2的氧化性质相近,在自来水消毒和果蔬保鲜等方面应用广泛.有关数据见下表:
化学式 | Cl2O | ClO2 | Cl2O7 |
沸点/℃ | 3.8 | 11.0 | 82.0 |
请回答下列问题:
(1)常温、常压下,三种氧化物中属于气体的是 .
(2)ClO2是第四代高效、无毒的广谱消毒剂.它可由NaClO2溶液与NCl3溶液反应制得,其反应的离子方程式为NCl3+6ClO ![]() +3H2O═6ClO2+3Cl﹣+3OH﹣+Y,则Y的化学式是 .
+3H2O═6ClO2+3Cl﹣+3OH﹣+Y,则Y的化学式是 .
(3)NaClO2在酸性条件下可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式是 .
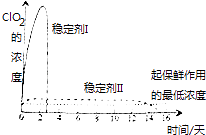
(4)已吸收ClO2的稳定性Ⅰ和Ⅱ,加酸后释放ClO2的浓度随时间的变化如图所示,若将其用于水果保鲜,你认为效果较好的稳定剂是 , 其原因是 .