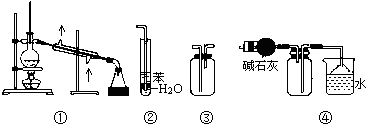��Ŀ����
����Ŀ��ij��ѧС���ͬѧģ�ҵ�������������ͼ��ʾ��װ�ã�
��֪��CaCl2+nH2O��CaCl2nH2O�� CaCl2+8NH3��[Ca��NH3��8]Cl2
�����������������գ�
��1����Һ©���а�ˮ��Ũ��Ϊ9.0mol/L��������������Ϊ0.35���ܶ�Ϊ0.88g/cm3�İ�ˮ����9.0mol/L�İ�ˮ100mL����Ҫ�Ķ�����������ѡ���ţ���a��100mL����ƿ b��10mL��Ͳ c��50mL��Ͳ d��������ƽ
��2������ʱ�����з�Ӧ�Ļ�ѧ����ʽΪ ��
��3��ʵ�鿪ʼ�ȼ��ȴ����������������ʱ�ٴ�Һ©�����������߾ƾ��ƣ��ɹ۲쵽�������У�����Cr2O3���ܱ��ֺ���״̬��������ƿ��������ɫת��Ϊɫ���Թ����ʯ����Һ��
��4������ʢ�ŵ�ҩƷΪ��ѡ�����б�ţ�����Ŀ���� �� a��ŨH2SO4 b����ˮCaCl2 c����ʯ�� d����ˮCuSO4
��5�����г���NO֮�⣬�����ܴ��ڵ�����������д��ѧʽ�����ձ��п��ܷ����ķ�Ӧ�Ļ�ѧ����ʽ�� ��
���𰸡�
��1��a��c
��2��4NH3+5O2 ![]() 4NO+6H2O
4NO+6H2O
��3���ޣ����أ�����ɫ��Ϊ��ɫ
��4��b������ˮ������NH3
��5��N2��O2��NO2��N2O4����2NO2+2NaOH=NaNO2+NaNO3+H2O��NO+NO2+2NaOH=2NaNO2+H2O
���������⣺��1��Ũ��ˮ��Ũ��C= ![]() =
= ![]() =18.1mol/L��Ũ��ˮϡ��ǰ�����ʵ����ʵ������䣬��Ũ��ˮ�����ΪV������18.1mol/L��V=9.0mol/L��0.1L��V=0.0497L=49.7mL������ѡ��100mL����ƿ��50mL��Ͳ�����Դ��ǣ�a��c����2������ʱ������Ϊ�����������ڴ������������·�����Ӧ����һ��������ˮ������ʽΪ��4NH3+5O2
=18.1mol/L��Ũ��ˮϡ��ǰ�����ʵ����ʵ������䣬��Ũ��ˮ�����ΪV������18.1mol/L��V=9.0mol/L��0.1L��V=0.0497L=49.7mL������ѡ��100mL����ƿ��50mL��Ͳ�����Դ��ǣ�a��c����2������ʱ������Ϊ�����������ڴ������������·�����Ӧ����һ��������ˮ������ʽΪ��4NH3+5O2 ![]() 4NO+6H2O�����Դ��ǣ�4NH3+5O2
4NO+6H2O�����Դ��ǣ�4NH3+5O2 ![]() 4NO+6H2O����3��ʵ�鿪ʼ�ȼ��ȴ����������������ʱ�ٴ�Һ©�����������߾ƾ��ƣ������ɵ�һ��������װ�õ�������Ӧ���ɺ���ɫ�Ķ����������壬������������ʯ����Һ�������������ԣ�����ʯ����Һ����ɫ��Ϊ��ɫ�����Կɹ۲쵽�������ж�����ƿ����������ɫת��Ϊ����ɫ���Թ����ʯ����Һ����ɫ��Ϊ��ɫ�����Դ��ǣ��ޣ�����ɫ������ɫ��Ϊ��ɫ����4����Ϊ�������ܣ�Ϊ�˳�ȥ�����İ�����ˮ����������ʢ�ŵ�ҩƷΪ��ˮCaCl2�����Դ��ǣ�b������ˮ������NH3����5����Ϊװ���к�������һ���������������ɶ�������������������ת����N2O4 �� ���Զ��г���NO֮�⣬�����ܴ��ڵ�������N2��O2��NO2 ��N2O4������������������Ϊ�����ն����NO��NO2β�������Է�Ӧ����ʽΪ2NO2+2NaOH=NaNO2+NaNO3+H2O��NO+NO2+2NaOH=2NaNO2+H2O�����Դ��ǣ�N2��O2��NO2 ��N2O4����2NO2+2NaOH=NaNO2+NaNO3+H2O��NO+NO2+2NaOH=2NaNO2+H2O��
4NO+6H2O����3��ʵ�鿪ʼ�ȼ��ȴ����������������ʱ�ٴ�Һ©�����������߾ƾ��ƣ������ɵ�һ��������װ�õ�������Ӧ���ɺ���ɫ�Ķ����������壬������������ʯ����Һ�������������ԣ�����ʯ����Һ����ɫ��Ϊ��ɫ�����Կɹ۲쵽�������ж�����ƿ����������ɫת��Ϊ����ɫ���Թ����ʯ����Һ����ɫ��Ϊ��ɫ�����Դ��ǣ��ޣ�����ɫ������ɫ��Ϊ��ɫ����4����Ϊ�������ܣ�Ϊ�˳�ȥ�����İ�����ˮ����������ʢ�ŵ�ҩƷΪ��ˮCaCl2�����Դ��ǣ�b������ˮ������NH3����5����Ϊװ���к�������һ���������������ɶ�������������������ת����N2O4 �� ���Զ��г���NO֮�⣬�����ܴ��ڵ�������N2��O2��NO2 ��N2O4������������������Ϊ�����ն����NO��NO2β�������Է�Ӧ����ʽΪ2NO2+2NaOH=NaNO2+NaNO3+H2O��NO+NO2+2NaOH=2NaNO2+H2O�����Դ��ǣ�N2��O2��NO2 ��N2O4����2NO2+2NaOH=NaNO2+NaNO3+H2O��NO+NO2+2NaOH=2NaNO2+H2O��

 ��һ������Ԫͬ�����ؾ�ϵ�д�
��һ������Ԫͬ�����ؾ�ϵ�д�