题目内容
【题目】有机物A常用于食品行业.已知9.0g A在足量O2中充分燃烧,将生成的混合气体依次通过足量的浓硫酸和碱石灰,分别增重5.4g和13.2g,经检验剩余气体为O2 .
(1)A分子的质谱图如图所示,从图中可知其相对分子质量是90,则A的分子式是
(2)A能与NaHCO3溶液发生反应,A一定含有的官能团名称是
(3)A分子的核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则A的结构简式是 .
(4)0.1mol A与足量Na反应,在标准状况下产生H2的体积是L.
(5)A在一定条件下可聚合得到一种聚酯,用于制造手术缝合线,其反应的化学方程式是 . 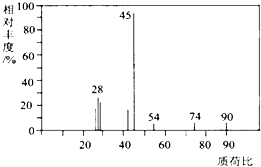
【答案】
(1)C3H6O3
(2)羧基
(3)CH3CH(OH)COOH
(4)2.24
(5)![]()
【解析】解:(1)5.4g水的物质的量为: ![]() =0.3mol,n(H)=0.6 mol,13.2g二氧化碳的物质的量为:
=0.3mol,n(H)=0.6 mol,13.2g二氧化碳的物质的量为: ![]() =0.3mol,n(C)=n(CO2)=0.3 mol,此有机物9.0g含O元素质量:9.0g﹣0.6g﹣0.3×12 g=4.8 g,n(O)=
=0.3mol,n(C)=n(CO2)=0.3 mol,此有机物9.0g含O元素质量:9.0g﹣0.6g﹣0.3×12 g=4.8 g,n(O)= ![]() =0.3 mol,故n(C):n(H):n(O)=0.3mol:0.6mol:0.3mol=1:2:1,即实验式为CH2O,设分子式为(CH2O)n,A的相对分子质量为90,可得30n=90,解得:n=3,故有机物A为C3H6O3 , 故答案为:C3H6O3;(2)A能与NaHCO3溶液发生反应,A一定含有羧基(﹣COOH),
=0.3 mol,故n(C):n(H):n(O)=0.3mol:0.6mol:0.3mol=1:2:1,即实验式为CH2O,设分子式为(CH2O)n,A的相对分子质量为90,可得30n=90,解得:n=3,故有机物A为C3H6O3 , 故答案为:C3H6O3;(2)A能与NaHCO3溶液发生反应,A一定含有羧基(﹣COOH),
故答案为:羧基;(3)有机物A为C3H6O3 , 核磁共振氢谱有4个峰,峰面积之比是1:1:1:3,则分子中4种H原子的数目为1、1、1、3,分子中含有1个﹣COOH、1个﹣CH3、1个 ![]() CH、1个﹣OH,有机物A的结构简式为CH3CH(OH)COOH,
CH、1个﹣OH,有机物A的结构简式为CH3CH(OH)COOH,
故答案为:CH3CH(OH)COOH;(4)有机物A含有﹣OH和﹣COOH,都能与Na反应生成氢气,反应的化学方程式为: ![]() ,由方程式可知0.1molA与足量Na反应生成氢气0.1mol,在标准状况下产生H2的体积是:0.1mol×22.4L/mol=2.24L,
,由方程式可知0.1molA与足量Na反应生成氢气0.1mol,在标准状况下产生H2的体积是:0.1mol×22.4L/mol=2.24L,
故答案为:2.24;(5)有机物A含有﹣OH和﹣COOH,聚合反应得到聚酯的反应方程式为: ![]() ,
,
故答案为: ![]() .
.
(1)根据浓硫酸增重5.4g为水的质量,碱石灰增重13.2g为二氧化碳的质量,根据质量守恒计算氧元素的质量,进而计算最简式,再结合相对分子质量计算分子式;(2)A能与NaHCO3溶液发生反应,A一定含有羧基(﹣COOH);(3)分子的核磁共振氢谱有4个峰,说明分子中含有4种H原子,峰面积之比是1:1:1:3,则4种H原子的数目之比为1:1:1:3,结合分子式判断分子结构;(4)结合有机物的结构判断与钠的反应,进而计算生成氢气的体积;(5)根据有机物A的结构与酯化反应原理书写反应方程式.

【题目】溴苯是一种化工原料,实验室合成溴体的装置示意图及有关数据如表:
苯 | 溴 | 溴苯 | |
密度/gcm﹣3 | 0.88 | 3.10 | 1.50 |
沸点/℃ | 80 | 59 | 156 |
水中溶解度 | 微溶 | 微溶 | 微溶 |
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑.在b中小心加入4.0mL液态溴.再将b中的液溴慢慢加入a中,充分反应.装置a中主要反应:;装置d的作用 .
(2)反应过程中,a外壁温度升高.为提高原料的利用率,可采取以下措施:
①采用装置c进行冷凝回流,回流的主要物质有 .
②利用温度计控制温度,适宜的温度范围为(填序号).
A.>156℃B.59℃﹣80℃C.<59℃
(3)液溴滴完后,经过下列步骤分离提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL 10%的NaOH溶液、10mL水洗涤.
③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤.
步骤②中NaOH溶液洗涤的主要作用是(用化学方程式表示);
(4)经以上分离操作后,粗溴苯中还含有的主要杂质为 , 要进一步提纯,下列操作中必须的是(填序号).
A.分液 B.过滤 C.蒸馏 D.萃取
(5)在该实验中,a的容积最适合的是(填序号).
A.25mL
B.50mL
C.250mL
D.500mL