��Ŀ����
��2014���Ϻ���ʮ��У�������Ի�ѧ�Ծ���
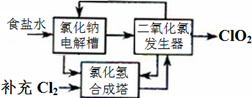
������������Ƭ����Ч�ɷ֣�ClO2����һ�ָ�Ч����ȫ��ɱ������������
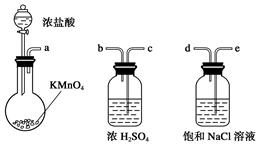
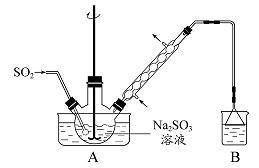
����һ���Ȼ��Ƶ�ⷨ��һ�ֿɿ��Ĺ�ҵ����ClO2����ķ������÷�����ԭ����ͼ��������ǽ�ʳ��ˮ���ض������µ��õ��������ƣ�NaClO3�������ᷴӦ����ClO2��
��1�������п����õĵ�����__________���ѧʽ����������������ClO2�Ļ�ѧ����ʽΪ_____________��
��2���˷���ȱ����Ҫ��______________________________________��
���������������ѧ�����о�����һ���µ��Ʊ���������ά�ػ�ԭ����ClO2����ԭ���ǣ���ά��ˮ��õ������ղ���X��NaClO3��Ӧ����ClO2��
��3����ƽ����ʽ�� �� ��X�� +��NaClO3+��H2SO4����ClO2��+��CO2��+��H2O+��______
����Ӧ�в���4.48L������ɱ�״���£����壬����ת��________ ����
��4��ClO2��Cl2���ܽ���Ʒ�ˮ�е�CN������Ϊ�������ʣ���������ԭΪCl����������CN����ͬ���ĵ�Ʒ�ˮ������Cl2�����ʵ�����ClO2��_______����
��������ʵ���ҳ���������(NaClO3)����������(Na2SO3)�������ữ�������Ʊ��������ȣ���ѧ��Ӧ����ʽΪ��2NaClO3+Na2SO3��H2SO4 2ClO2��+2Na2SO4��H2O
2ClO2��+2Na2SO4��H2O
��5����Ӧ�е�Na2SO3��Һ�д�������ƽ�⣺H2O H++OH-�� ________________�������ӷ���ʽ��ʾ��.
H++OH-�� ________________�������ӷ���ʽ��ʾ��.
�����£�0.1mol/L����Һ������Ũ���ɴ�С����__________________�������ӷ��ű�ʾ��
��6�������£���֪NaHSO3��Һ�����ԣ���Na2SO3��Һ�еμ�ϡ����������ʱ�����ʵ���Ҫ�ɷ���________________�����û�ѧʽ��ʾ��
������������Ƭ����Ч�ɷ֣�ClO2����һ�ָ�Ч����ȫ��ɱ������������
����һ���Ȼ��Ƶ�ⷨ��һ�ֿɿ��Ĺ�ҵ����ClO2����ķ������÷�����ԭ����ͼ��������ǽ�ʳ��ˮ���ض������µ��õ��������ƣ�NaClO3�������ᷴӦ����ClO2��

��1�������п����õĵ�����__________���ѧʽ����������������ClO2�Ļ�ѧ����ʽΪ_____________��
��2���˷���ȱ����Ҫ��______________________________________��
���������������ѧ�����о�����һ���µ��Ʊ���������ά�ػ�ԭ����ClO2����ԭ���ǣ���ά��ˮ��õ������ղ���X��NaClO3��Ӧ����ClO2��
��3����ƽ����ʽ�� �� ��X�� +��NaClO3+��H2SO4����ClO2��+��CO2��+��H2O+��______
����Ӧ�в���4.48L������ɱ�״���£����壬����ת��________ ����
��4��ClO2��Cl2���ܽ���Ʒ�ˮ�е�CN������Ϊ�������ʣ���������ԭΪCl����������CN����ͬ���ĵ�Ʒ�ˮ������Cl2�����ʵ�����ClO2��_______����
��������ʵ���ҳ���������(NaClO3)����������(Na2SO3)�������ữ�������Ʊ��������ȣ���ѧ��Ӧ����ʽΪ��2NaClO3+Na2SO3��H2SO4
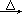 2ClO2��+2Na2SO4��H2O
2ClO2��+2Na2SO4��H2O��5����Ӧ�е�Na2SO3��Һ�д�������ƽ�⣺H2O
 H++OH-�� ________________�������ӷ���ʽ��ʾ��.
H++OH-�� ________________�������ӷ���ʽ��ʾ��.�����£�0.1mol/L����Һ������Ũ���ɴ�С����__________________�������ӷ��ű�ʾ��
��6�������£���֪NaHSO3��Һ�����ԣ���Na2SO3��Һ�еμ�ϡ����������ʱ�����ʵ���Ҫ�ɷ���________________�����û�ѧʽ��ʾ��
��1��H2��Cl2 2NaClO3+ 4HCl=2ClO2��+Cl2��+ 2NaCl + 2H2O
��2��ͬʱ�����˴������������������ʵͣ����Ҳ�Ʒ���Է��룬ͬʱ���п�����ɻ�����Ⱦ���ܺĽϴ��
��3��1C6H12O6+24NaClO3+12H2SO4��24ClO2��+6CO2��+18H2O+12Na2SO4�� 0.16NA��
��4��2.5
��5��SO32- +H2O
 OH-+HSO3-�� HSO3- +H2O
OH-+HSO3-�� HSO3- +H2O OH-+H2SO3��Na+ SO32- OH- HSO3- H +
OH-+H2SO3��Na+ SO32- OH- HSO3- H +��6��NaHSO3��Na2SO3�� NaCl����NaHSO3��Na2SO3�� NaCl��SO2��H2SO3��
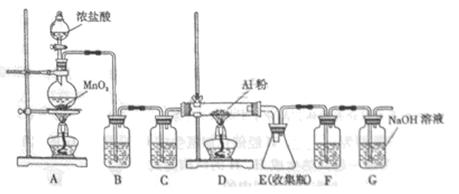
��1���й�������ͼ���Կ������ڸù����п����õĵ�����H2��Cl2 ����������ͼ�������غ㶨�ɼ������غ���ɿɵó��ڷ�����������ClO2�Ļ�ѧ����ʽΪ: 2NaClO3+ 4HCl=2ClO2��+Cl2��+ 2NaCl + 2H2O
��2���� �Ʊ�ԭ��������ͼ��֪�˷���ȱ����Ҫ�ǻ����������Cl2�����Ĵ����ĵ��ܣ�����ClO2��Cl2�����������룬�������������ʵͣ���������ɴ�����Ⱦ��
��3����ά��ˮ��õ������ղ���X��������C6H12O6������NaClO3�����������·�����Ӧ�����������غ㶨�ɺ͵����غ��֪ʶ�ɵ÷���ʽΪ1C6H12O6+24NaClO3+12H2SO 4��24ClO2��+6CO2�� +18H2O+ 12Na2SO4���ɷ���ʽ���Կ���ÿ����30mol�����壬ת�Ƶ���24NA�����ڲ�����������ʵ���Ϊ4.48L ��22.4L/mol=0.2mol������ת�Ƶ��ӵ����ʵ���Ϊ24NA��30��0.2="0.16" NA
��4��������CN����ͬ���ĵ�Ʒ�ˮ����ת�Ƶ��ӵ����ʵ�����ͬ������ת�Ƶ���2mol������ҪCl2�����ʵ�����1mol����ҪClO2�����ʵ���Ϊ2��=0.4mol������n(Cl2): n(ClO2)=1:0.4=2.5��
��5����Ӧ�е�Na2SO3��Һ�д�������ƽ�⣺H2O
 H++OH-��SO32-��ˮ��ƽ������ַ���ʽ������SO32-�Ƕ�Ԫ�����������ӣ���˴�������ˮ��ƽ��SO32- +H2O
H++OH-��SO32-��ˮ��ƽ������ַ���ʽ������SO32-�Ƕ�Ԫ�����������ӣ���˴�������ˮ��ƽ��SO32- +H2O  OH-+HSO3-�� HSO3- +H2O
OH-+HSO3-�� HSO3- +H2O  OH-+H2SO3��Na2SO3=2Na++ SO32-��c(Na+)>c(SO32-).SO32-ˮ�����OH-��HSO3-��HSO3-��һ��ˮ�Ҫ����HSO3-��ͬʱ����OH-�����c(OH-)>c(HSO3-).����Һ�л�����ˮ�ĵ���ƽ�⣬����c(HSO3-)>c(H+).����Һ����ˮ��ij̶��Ǻ����ģ�����c(SO32-)> c(OH-)������ڸ���Һ�и������ӵ�Ũ���ɴ�С��˳��Ϊc(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)��
OH-+H2SO3��Na2SO3=2Na++ SO32-��c(Na+)>c(SO32-).SO32-ˮ�����OH-��HSO3-��HSO3-��һ��ˮ�Ҫ����HSO3-��ͬʱ����OH-�����c(OH-)>c(HSO3-).����Һ�л�����ˮ�ĵ���ƽ�⣬����c(HSO3-)>c(H+).����Һ����ˮ��ij̶��Ǻ����ģ�����c(SO32-)> c(OH-)������ڸ���Һ�и������ӵ�Ũ���ɴ�С��˳��Ϊc(Na+)>c(SO32-)> c(OH-)>c(HSO3-)>c(H+)����6����Na2SO3��Һ�еμ�ϡ������ǡ�÷�����Ӧ��Na2SO3+HCl=NaCl+NaHSO3��������NaHSO3��Һ�����ԡ�����������ʱ��n(HCl)<n(Na2SO3).������Һ�к��е�������δ��Ӧ��Na2SO3����Ӧ���ɵ�NaCl��NaHSO3��������Na2SO3��NaCl��NaHSO3��Ҳ���ܵμ�HCl�ֲ����������SO2��H2SO3�ܽ��ڸ���Һ�л�����SO2��H2SO3��

��ϰ��ϵ�д�
�����Ŀ
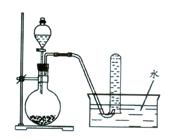
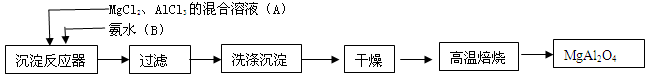
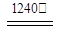 2Al2O3 + 2NH3��+ N2��+ 5SO3��+ 3SO2��+ 53H2O,������������ͨ��ͼ9��ʾ��װ�á�
2Al2O3 + 2NH3��+ N2��+ 5SO3��+ 3SO2��+ 53H2O,������������ͨ��ͼ9��ʾ��װ�á�

 3Zn(OH)2 + 2Fe(OH)3 + 4KOH
3Zn(OH)2 + 2Fe(OH)3 + 4KOH