题目内容
【题目】某工厂综合处理含 NH4+废水和工业废气(主要含 N2、CO2、SO2、NO、CO,不考虑其他成分),设计的流程如下图,回答下列问题:
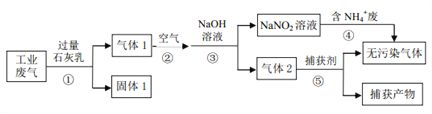
(1)固体 1的主要成分有______(填化学式)。
(2)反应①需控制反应的温度和气体的流速,其共同目的是______。
(3)反应④的离子方程式为______。
(4)已知:2NO2+2NaOH=NaNO3+NaNO2+H2O,NO2+NO+2NaOH=2NaNO2+H2O
在同温同压下,当反应②中NO与空气的体积比为______,经反应③,气体中NOx被完全吸收且仅生成 NaNO2。(设空气中氧气所占体积分数为 0.2)
(5)CuCl 的氨溶液常用作反应⑤的捕获剂。将(NH4)2SO3、NH4Cl与CuSO4 3种溶液相混可制得难溶物 CuCl。
① 理论上,(NH4)2SO3与CuSO4恰好反应时,n(SO32-):n(Cu2+)=______。
② 实际上, (NH4)2SO3的用量与 Cu2+的沉淀率关系如图所示,显然Cu2+沉淀率最高时,(NH4)2SO3的用量高于理论值其原因是______。

【答案】 Ca(OH)2、CaCO3、CaSO3 使气体被充分吸收 NH4+ + NO2-=N2↑+ 2H2O 4: 5 1: 2 有少量(NH4)2SO3在反应过程被空气中的氧化
【解析】(1)工业废气(主要含 N2、CO2、SO2、NO、CO)与过量石灰乳反应固体1中有生成溶解性的较小的CaCO3、CaSO3及未反应过量的Ca(OH)2,即固体1中的主要成分;(2)温度过高不利于气体的溶解及参与反应,气流过快,来不及反应,也不利于气体的充分吸收;(3)气体1的成分是CO、NO、N2,常温下它们与空气一起通过NaOH溶液生成了NaNO2,NaNO2与铵根离子发生归中反应,生成无污染的气体即氮气,离子方程式为:NH4+ + NO2-=N2↑+ 2H2O;(4)当反应②中NO与空气的氧气反应的NOx被完全吸收且仅生成 NaNO2。NaNO2中N为+3价,根据电子守恒,每生成1mol NaNO2需要1mol电子,即1/4mol氧气,NO与空气的体积比为4: 5;(5)①理论上,(NH4)2SO3与CuSO4恰好反应,根据氧化还原反应电子守恒,n(SO32-)×2= n(Cu2+)×1,n(SO32-):n(Cu2+)=1: 2,由(NH4)2SO3的用量与 Cu2+的沉淀率关系图所,0.6之后,(NH4)2SO3的用量增加与Cu2+的沉淀率无关,说明有部分(NH4)2SO3没有还原Cu2+,而是被空气中的氧气氧化了。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】氮是地球上含量最丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用。回答下列问题:
(1)在0.5L的密闭容器中,一定量的氮气和氢气进行如下化学反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
2NH3(g) △H<0,其化学平衡常数K与温度t的关系如下表:
t/℃ | 200 | 300 | 400 |
K | K1 | K2 | 0.5 |
在200℃时,当测得NH3和N2、H2的物质的量分别为1mol和0.5mol、1mol时,则该反应的v(N2)正____v(N2)逆(填写“>”、“=”或“<”)。
(2)结合表中给出的电离常数回答下列问题:
酸或碱 | CH3COOH | HNO2 | HCN | HClO |
电离平衡常数(Ka或Kb) | 1.8×10-5 | 4.6×10-4 | 5×10-10 | 3×10-8 |
①上述四种酸中,酸性最弱、最强的酸分别是_______、____(用化学式表示)。
②下列能使醋酸溶液中CH3COOH的电离程度增大,而电离平衡常数不变的操作是____(填序号)。
A.升高温度 B.加水稀释 C.加少量的CH3COONa固体 D.加少量冰醋酸 E.加氢氧化钠固体
③依上表数据判断醋酸和次氯酸钠溶液能否反应,如果不能反应说出理由,如果能发生反应请写出相应的离子方程式_______。