题目内容
【题目】(Ⅰ)下图是常见仪器的部分结构。

(1)写出仪器名称A__________,B__________,C__________,D__________。
(2)使用前需检查是否漏水的仪器有____________(填字母)。
(Ⅱ)已知常温下氢氧化铜的Ksp=2×10-20。
(3)某硫酸铜溶液里c(Cu2+)=0.02mol/L,若要生成Cu(OH)2沉淀,应调整溶液pH使之大于_________。
(4)要使0.2mol/ LCuSO4溶液中Cu2+沉淀较为完全(Cu2+浓度降至原来的千分之一),则应向溶液里加入NaOH溶液使溶液pH为______________。
【答案】 量筒 容量瓶 滴定管 温度计 BC 5 6
【解析】(1)依据仪器的形状及构造特点判断其名称;
(2)凡是带有活塞,旋塞的仪器使用前一般需要检查是否漏水;
(3)浓度熵大于溶度积常数时会产生沉淀;
(4)根据溶度积常数的表达式计算。
(1)仪器A带有刻度,小数在下,大数在上,为量筒;仪器B带有瓶塞,且瓶颈细,有刻度线无刻度为容量瓶;C带有刻度,小数在上,大数在下,为滴定管;仪器D中有0℃以下的刻度,是温度计;
(2)容量瓶带有活塞,滴定管带有旋塞,为防止漏液,使用前应检查是否漏水,答案选BC;
(3)某硫酸铜溶液里c(Cu2+)=0.02mol/L,若要生成Cu(OH)2沉淀,则c(Cu2+)·c2(OH-)>2×10-20,解得c(OH-)>10-9mol/L,因此应调整溶液pH使之大于5。
(4)要使0.2mol/LCuSO4溶液中Cu2+沉淀较为完全(Cu2+浓度降至原来的千分之一,铜离子浓度变为2×10-4mol/L),则溶液中c(OH-)=![]() =10-8mol/L,pH=6,即应向溶液里加入NaOH溶液使溶液pH为6。
=10-8mol/L,pH=6,即应向溶液里加入NaOH溶液使溶液pH为6。

【题目】在生产生活中,酸碱中和及溶液酸碱性研究具有十分重要的意义。
(1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
组别 | c(一元酸) | c(NaOH) | 混合溶液的pH |
甲 | c(HY)=0.1mol/L | 0.1mol/L | pH=7 |
乙 | c(HZ)=0.1mol/L | 0.1mol/L | pH=9 |
①甲组实验中HY为_________(填强、弱)酸,0.1 moL/L HY溶液的pH=_____________。
②乙组实验中发生反应的离子方程式为_________________________________。
③乙组实验所得溶液中由水电离出的c(OH-)=________ mol/L。
(2)常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL0.1000mol/LHCl溶液和20.00mL 0.1000mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示。
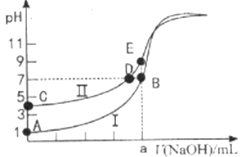
①滴定HCl溶液的曲线是___________(填“I”或“Ⅱ”);
②a=__________ mL。
③c(Na+)=c(CH3COO-)的点是_____________。
④E点对应离子浓度由大到小的顺序为_________________。
(3)将一定量某浓度的NaOH溶液,加入MgCO3悬浊液中,可以生成更难溶的Mg(OH)2。该反应的离子方程式为_____________________________。