题目内容
【题目】(1)![]() 可用作食盐的抗结剂,高温下
可用作食盐的抗结剂,高温下![]() 会分解生成
会分解生成![]() 、KCN、
、KCN、![]() 、
、![]() C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为______;
C、C等物质,上述物质中涉及的几种元素的第一电离能由大到小的顺序为______;![]() 中,铁原子不是采用
中,铁原子不是采用![]() 杂化的理由是______。
杂化的理由是______。
(2)![]() 气态为单分子时,分子中S原子的杂化轨道类型为______,分子的立体构型为______;
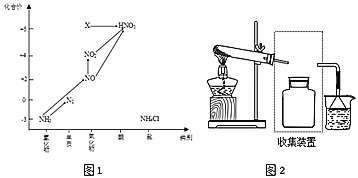
气态为单分子时,分子中S原子的杂化轨道类型为______,分子的立体构型为______;![]() 的三聚体环状结构如图1所示,该结构中
的三聚体环状结构如图1所示,该结构中![]() 键长有a、b两类,b的键长大于a的键长的可能原因为______。
键长有a、b两类,b的键长大于a的键长的可能原因为______。
(3)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域![]() 键”
键”![]() 或大
或大![]() 键
键![]() 。大
。大![]() 键可用
键可用![]() 表示,其中m、n分别代表参与形成大
表示,其中m、n分别代表参与形成大![]() 键的电子数和原子个数,如苯分子中大
键的电子数和原子个数,如苯分子中大![]() 键表示为
键表示为![]() 。
。
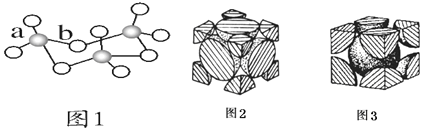
①下列微粒中存在“离域![]() 键”的是______;
键”的是______;
A.![]()
![]()
![]()
![]()
②![]() 分子中大
分子中大![]() 键可以表示为______;
键可以表示为______;
(4)铁、钾两种单质的堆积方式剖面图分别如图2、图3所示。铁晶体中原子的空间利用率为______![]() 用含
用含![]() 的式子表示
的式子表示![]() 。
。
【答案】![]()
![]() 中
中![]() 配位数为6
配位数为6 ![]() V形 形成b键的氧原子与两个S原子结合,原子之间形成单键,作用力较小
V形 形成b键的氧原子与两个S原子结合,原子之间形成单键,作用力较小 ![]()
![]()
![]()
【解析】
(1)第一电离能实际上就是失电子的难易程度,电离能越小则代表失电子越容易,则还原性越强,因此可以从氧化还原性的强弱来考虑;
(2)键长与键能呈负相关,即键越长则能量越低,越容易断裂;对于稳定性而言是三键>双键>单键,则键长是单键>双键>三键;
(3)题干中已经告知我们大![]() 键的形成条件,因此我们只要从这些微粒的分子结构来判断存不存在相互平行的p轨道即可;
键的形成条件,因此我们只要从这些微粒的分子结构来判断存不存在相互平行的p轨道即可;
(4)利用率即“原子的体积占整个晶胞体积的百分比”,分别算出二者的体积再构造分式即可。
![]() 一般金属性越强则第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,IIA族、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:
一般金属性越强则第一电离能越小,同周期主族元素随原子序数增大第一电离能呈增大趋势,IIA族、VA族为全充满或半充满稳定状态,第一电离能高于同周期相邻元素的,故第一电离能:![]() ;
;![]() 与
与![]() 形成6个配位键,
形成6个配位键,![]() 配位数为6,
配位数为6,![]() 杂化无法形成6个空轨道;
杂化无法形成6个空轨道;
![]() 分子中S原子形成2个
分子中S原子形成2个![]() 键,孤电子对数为
键,孤电子对数为![]() ,价层电子对数
,价层电子对数![]() ,故分子中S原子的杂化轨道类型为
,故分子中S原子的杂化轨道类型为![]() 杂化,分子的立体构型为V形;连接2个S原子的氧原子与S原子之间形成单键,连接1个S原子的氧原子与S之间形成双键,单键之间作用力比双键弱,单键的键长较长;
杂化,分子的立体构型为V形;连接2个S原子的氧原子与S原子之间形成单键,连接1个S原子的氧原子与S之间形成双键,单键之间作用力比双键弱,单键的键长较长;
![]() 形成离域
形成离域![]() 键的条件是“原子都在同一平面上且这些原子有相互平行的p轨道“,硫酸根离子是正四面体结构,原子不处于同一平面内,硫化氢中H原子和S原子没有平行的p轨道,
键的条件是“原子都在同一平面上且这些原子有相互平行的p轨道“,硫酸根离子是正四面体结构,原子不处于同一平面内,硫化氢中H原子和S原子没有平行的p轨道,![]() 为V形结构,
为V形结构,![]() 为平面三角形,有相互平行的p轨道,可以形成离域
为平面三角形,有相互平行的p轨道,可以形成离域![]() 键,
键,
故答案为AD;
![]() 为直形型结构,有相互平行的p轨道,
为直形型结构,有相互平行的p轨道,![]() 分子中大
分子中大![]() 键可以表示为:
键可以表示为:![]() ;
;
![]() 铁的晶体为面心立方最密堆积,令Fe原子的半径为rcm,则晶胞的棱长为
铁的晶体为面心立方最密堆积,令Fe原子的半径为rcm,则晶胞的棱长为![]() ,晶胞体积
,晶胞体积![]()
![]() ,晶胞中Fe原子数目
,晶胞中Fe原子数目![]() ,晶胞中Fe原子总体积
,晶胞中Fe原子总体积![]() ,晶胞中原子的空间利用率
,晶胞中原子的空间利用率![]()
![]() 。
。

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案