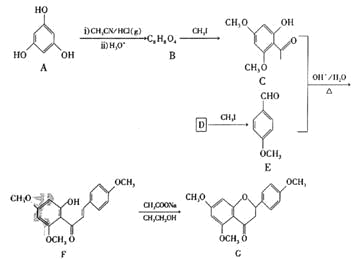
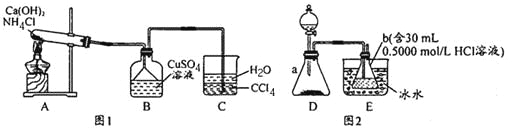
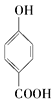
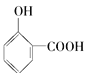
题目内容
【题目】下列有关说法正确的是:
A.氢气燃烧热为285.5kJ·mol-1,则2H2O(l)=2H2(g)+O2(g) △H=+285.5 kJ·mol-1
B.等pH的强碱与弱碱,稀释相同的倍数,弱碱pH值偏小
C.中和热的实验过程中,环形玻璃搅拌棒如果用铜代替,则测量出的中和热数值偏小
D.已知N2(g)+3H2(g)![]() 2 NH3(g) ;△H=-92.4kJ·mol-1,则在一定条件下将1molN2和4molH2置于一密闭容器中充分反应后,最多可放出92.4kJ的热量
2 NH3(g) ;△H=-92.4kJ·mol-1,则在一定条件下将1molN2和4molH2置于一密闭容器中充分反应后,最多可放出92.4kJ的热量
【答案】C
【解析】
A. 氢气的燃烧热为285.5 kJmol-1,燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,则水分解的热化学方程式为:2H2O(l)=2H2(g)+O2(g);△H=+571.6 kJmol-1,A项错误;
B. 弱碱溶液存在电离平衡,加水稀释会促进弱碱的电离,使溶质再电离一部分氢氧根离子,等pH的强碱与弱碱,稀释相同的倍数,弱碱中的氢氧根离子减小的倍数小于稀释倍数,导致最终pH值较强碱的偏大,B项错误;
C. 中和热的实验过程中,环形玻璃搅拌棒如果用铜代替,由于铜的导热性强,导致实验过程中热量散失多,则测量出的中和热数值偏小,C项正确;
D. 已知N2(g)+3H2(g)![]() 2 NH3(g) ;△H=-92.4kJ·mol-1,反应是可逆反应,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,放出热量小于92.4kJ,D项错误;
2 NH3(g) ;△H=-92.4kJ·mol-1,反应是可逆反应,则在一定条件下将1molN2和3molH2置于一密闭容器中充分反应后,放出热量小于92.4kJ,D项错误;
答案选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的简化核外电子排布式为__,有__个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键,从原子结构角度分析,原因是__。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因__。
GeCl4 | GeBr4 | GeI4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂,Zn、Ge、O电负性由大至小的顺序是__。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__,微粒之间存在的作用力是___。
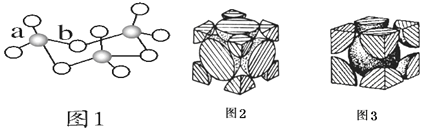
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C为(
);C为(![]() ,
,![]() ,0)。则D原子的坐标参数为__。
,0)。则D原子的坐标参数为__。
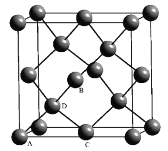

②晶胞参数,描述晶胞的大小和形状。已知单晶Ge的晶胞参数a=565.76pm,其密度为___g·cm-3(列出计算式即可)。