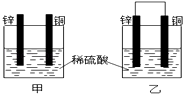
题目内容
【题目】把主族元素X的最高价氧化物X2O 4.7g溶于95.3g水中,得到溶质质量分数为5.6%的溶液,Y与X位于同一族,12g Y的氢氧化物与400mL 0.75molL ﹣1的盐酸完全中和,Z与Y同周期,标准状况下5.6L ZO2为16g.
(1)求X、Y、Z的相对原子质量;
(2)写出其元素符号.
【答案】
(1)答:X相对原子质量为39,Y的相对原子质量为23,Z的相对原子质量为32
(2)答:X、Y、Z的元素符号分别为K、Na、S
【解析】解:(1)主族元素X的最高价氧化物X2O,X处于IA族,溶于水生成XOH,4.7g X2O 溶于95.3g水中,得到溶质质量分数为5.6%的溶液,则XOH的质量=(4.7g+95.3g)×5.6%=5.6g,令X的相对原子质量为a,则根据X原子守恒:2× ![]() =
= ![]() ,解得a=39,
,解得a=39,
元素Y与X同主族,则Y也处于IA族,其氢氧化物为YOH,与盐酸发生中和反应,设Y的相对原子质量b,则 ![]() =0.75mol/L×0.4L,解得b=23,
=0.75mol/L×0.4L,解得b=23,
标况下ZO2的物质的量为 ![]() =0.25mol,ZO2的摩尔质量为
=0.25mol,ZO2的摩尔质量为 ![]() =64g/mol,则Z的相对分子质量为64﹣32=32,
=64g/mol,则Z的相对分子质量为64﹣32=32,
答:X相对原子质量为39,Y的相对原子质量为23,Z的相对原子质量为32;(2)X、Y处于IA族,X相对原子质量为39,Y的相对原子质量为23,则X为K,Y为Na,Z的相对原子质量为32,且Z与Na同周期,故Z为S,
答:X、Y、Z的元素符号分别为K、Na、S.

练习册系列答案
相关题目