��Ŀ����
����Ŀ��A��B��C��D��E��F����Ԫ�ص�ԭ��������������A����ۺ���ͼ۵ľ���ֵ��ȣ�B�Ļ�̬ԭ����3����ͬ���ܼ��Ҹ��ܼ��е�������ȣ�D�Ļ�̬ԭ����B�Ļ�̬ԭ��δ�ɶԵ�����Ŀ��ͬ��E�Ļ�̬ԭ��s�ܼ��ĵ���������p�ܼ��ĵ�������ȣ�F�Ļ�̬ԭ�ӵ�3d�����4s��������4������ش��������⣺
��1��F�Ļ�̬ԭ�˼۵����Ų�ʽΪ��
��2��B��C��D��E��ԭ�ӵĵ�һ��������С�����˳��Ϊ������Ԫ�ط��Żش�
��3�����й���B2A2���Ӻ�A2D2���ӵ�˵����ȷ������
A.�����ж����ЦҼ��ͦм�
B.����ԭ�Ӷ�sp�ӻ�
C.���Ǻ����Լ��ͷǼ��Լ��ķǼ��Է���
D.��Ϊ�ȵ�����
E.B2A2���ӵķе����Ե���A2D2����
��4��F2+����BD�����γ�[F��BD��4]2+ �� ��ԭ����BD�����к�����
��5����B��E��F����Ԫ���γɵ�һ�־��г����Եľ��壬������ͼ��ʾ��Bλ��E��Fԭ�ӽ��ܶѻ����γɵĿ�϶���У���һ��Fԭ�Ӿ��������Fԭ�ӵ���ĿΪ �� �þ���Ļ�ѧʽΪ �� ���þ������Է�������ΪM�������ӵ�����ΪNA �� B��E��F����Ԫ�ص�ԭ�Ӱ뾶�ֱ�Ϊr1pm��r2pm��r3pm����þ�����ܶȱ���ʽΪ �� 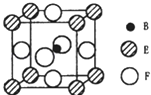
���𰸡�
��1��3d84s2
��2��Mg��C��O��N
��3��E
��4���µ��Ӷ�
��5��8��MgNi3C��![]()
��������A��B��C��D��E��F����Ԫ�ص�ԭ������������������B�Ļ�̬ԭ����3����ͬ���ܼ����Ҹ��ܼ��еĵ�������ȣ�ԭ�Ӻ�������Ų�ʽΪ1s22s22p2 �� ��BΪ̼Ԫ�أ�A��������ۺ�����۵ľ���ֵ��ȣ�ԭ����������̼����AΪHԪ�أ�E�Ļ�̬ԭ�ӵ�s�ܼ��ĵ���������p�ܼ��ĵ�������ȣ�ԭ�Ӻ�������Ų�ʽΪ1s22s22p4��1s22s22p63s2 �� D�Ļ�̬ԭ����B�Ļ�̬ԭ�ӵ�δ�ɶԵ�����Ŀ��ͬ��D��ԭ������С��E��ԭ�Ӻ�������Ų�ֻ��Ϊ1s22s22p4 �� ��DΪOԪ�أ���EΪMg����C��ԭ����������̼����֮�䣬��CΪNԪ�أ�F�Ļ�̬ԭ�ӵ�3d�����������4s��������4����4s����ֻ����2�����Ӳ㣬��ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d84s2 �� ��FΪNi����1��F�Ļ�̬ԭ�ӵ�3d�����������4s��������4����4s����ֻ����2�����Ӳ㣬3d�ܼ���8�����ӣ���ԭ�Ӻ�������Ų�Ϊ1s22s22p63s23p63d84s2 �� �۵����Ų�Ϊ3d84s2 ��
���Դ��ǣ�3d84s2����2��C��N��O��Mg����Ԫ�أ�Mg���ڽ�������һ��������С��C��N��Oͬ���ڣ���ԭ����������ĵ�һ�����ܳ��������ƣ���NԪ��2p�ܼ�����3�����ӣ����ڰ����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ��������С�����˳��ΪMg��C��O��N�����Դ��ǣ�Mg��C��O��N����3��A��C2H2�����к���C��C������C��H�������ЦҼ��ͦм�����H2O2����ΪH��O��O��H��ֻ���ЦҼ�����A����B��C2H2������Cԭ�ӳ�2���Ҽ���û�й¶Ե��ӣ��ӻ������ĿΪ2����ȡsp�ӻ���H2O2������Oԭ�ӳ�2���Ҽ�������2�Թµ��Ӷԣ��ӻ������ĿΪ4����ȡsp3�ӻ�����B����C��C2H2��ֱ���ͶԳƽṹ���ǷǼ��Է��ӣ���H2O2������չ����ҳ�νṹ�����ڼ��Է��ӣ���C����D��C2H2���ӡ�H2O2���Ӻ��е���������۵�����������ȣ����ǵȵ����壬��D����E��C2H2������Ϊ��̬����H2O2������ΪҺ̬����E��ȷ�����Դ��ǣ�E����4��Ni2+����CO����ͨ����λ���γ�[Ni��CO��4]2+ �� ��ԭ����CO�����к��йµ��Ӷԣ����Դ��ǣ��µ��Ӷԣ���5�����ϵ�������Fԭ���о�����֮���������Fԭ��λ�ھ����������漰ǰ���������ϣ��������ϵ���Ϊ�ϲ㾧�����µ��棬����֮�����Fԭ����8����
�ɾ���������֪��������Cԭ����Ŀ=1��NiԪ����Ŀ=6�� ![]() =3��Mgԭ����Ŀ=8��
=3��Mgԭ����Ŀ=8�� ![]() =1���ʸþ���Ļ�ѧʽΪMgNi3C����������=
=1���ʸþ���Ļ�ѧʽΪMgNi3C����������= ![]() g���ϵ���Խ��߳���=��2r2+2r3��pm=��2r2+2r3����10��10cm���ʾ����ⳤ=
g���ϵ���Խ��߳���=��2r2+2r3��pm=��2r2+2r3����10��10cm���ʾ����ⳤ= ![]() ����2r2+2r3����10��10cm=
����2r2+2r3����10��10cm= ![]() ��r2+r3����10��10cm���������=[
��r2+r3����10��10cm���������=[ ![]() ��r2+r3����10��10cm]3=2
��r2+r3����10��10cm]3=2 ![]() ��r2+r3��3��10��30cm3 �� �ʾ����ܶ�=
��r2+r3��3��10��30cm3 �� �ʾ����ܶ�= 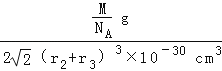 =
= 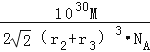 g��cm��3 �� ���Դ��ǣ�8��MgNi3C��
g��cm��3 �� ���Դ��ǣ�8��MgNi3C��  ��
��