题目内容
【题目】某无机盐M是一种优良的氧化剂,为确定其化学式,某小组设计并完成了如下实验: 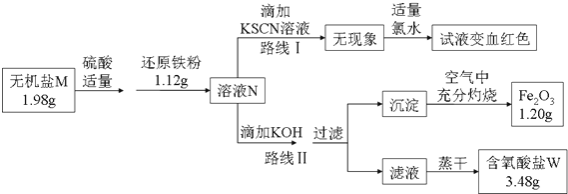
已知:①无机盐M仅由钾离子和一种含氧酸根组成,其分子中的原子个数比为2:1:4;
②如图中,将1.98g该无机盐溶于水,滴加适量稀硫酸后,再加入1.12g还原铁粉,恰好完全反应得混合溶液N.
③该小组同学将溶液N分为二等份,分别按路线Ⅰ、路线Ⅱ进行实验.
④在路线Ⅱ中,首先向溶液N中滴加适量KOH至元素X刚好沉淀完全,过滤后将沉淀在空气中充分灼烧得纯净的Fe2O3粉末1.20g;再将滤液在一定条件下蒸干,只得到3.48g纯净的不含结晶水的正盐W.
请按要求回答下列问题:
(1)由路线Ⅰ的现象可知,溶液N中含有的阳离子是;
(2)由实验流程图可推得,含氧酸盐W的化学式是 ;由路线Ⅱ可知,1.98g无机盐M中所含钾元素的质量为g;
(3)无机盐M与1.12g还原铁粉恰好完全反应生成溶液N的化学反应方程为 .
【答案】
(1)Fe2+
(2)Na2SO4;0.78
(3)2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O
【解析】1.2g氧化铁的物质的量为: ![]() =0.0075mol,则溶液N中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,故原来无机盐M中铁元素的物质的量为0.03mol﹣0.02mol=0.01mol;据题意得E为Na2SO4 , 2.84g Na2SO4物质的量为0.02mol,故无机盐W中含钠元素,依据W为含氧酸根,且分子中的原子个数比为1:2:4,可得M的化学式为K2FeO4 , (1)根据路线Ⅰ可知,N溶液中一定含有亚铁离子, 所以答案是:Fe2+;(2)1.2g氧化铁的物质的量为:
=0.0075mol,则溶液N中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,故原来无机盐M中铁元素的物质的量为0.03mol﹣0.02mol=0.01mol;据题意得E为Na2SO4 , 2.84g Na2SO4物质的量为0.02mol,故无机盐W中含钠元素,依据W为含氧酸根,且分子中的原子个数比为1:2:4,可得M的化学式为K2FeO4 , (1)根据路线Ⅰ可知,N溶液中一定含有亚铁离子, 所以答案是:Fe2+;(2)1.2g氧化铁的物质的量为: ![]() =0.0075mol,则溶液中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,无机盐M分子中的原子个数比为1:2:4,则M的化学式为:Na2FeO4 , 根据流程可知,Na2FeO4与稀硫酸、还原铁粉反应生成硫酸亚铁和硫酸钾,根据质量守恒可知W为硫酸钾,1.98gK2FeO4的物质的量为
=0.0075mol,则溶液中含有铁元素的物质的量为:0.0075mol×2×2=0.03mol,质量为:56g/mol×0.03mol=1.68g>1.12g,所以无机盐M中一定含有Fe元素,无机盐M分子中的原子个数比为1:2:4,则M的化学式为:Na2FeO4 , 根据流程可知,Na2FeO4与稀硫酸、还原铁粉反应生成硫酸亚铁和硫酸钾,根据质量守恒可知W为硫酸钾,1.98gK2FeO4的物质的量为 ![]() =0.01mol,0.01molK2FeO4中含有0.02mol钾离子,含有钾离子的质量为39g/mol×0.02mol=0.78g,
=0.01mol,0.01molK2FeO4中含有0.02mol钾离子,含有钾离子的质量为39g/mol×0.02mol=0.78g,
所以答案是:Na2SO4 ;0.78;(3)1.66gNa2FeO4的物质的量为0.01mol,1.12g还原铁粉的物质的量为0.02mol,所以Na2FeO4与还原铁粉按物质的量之比为1:2反应的化学反应方程为:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O,
所以答案是:2Fe+K2FeO4+4H2SO4═3FeSO4+K2SO4+4H2O.

 互动英语系列答案
互动英语系列答案