题目内容
【题目】(1)实验室少量的金属钠保存在___________中,取用时用到的仪器和用品有小刀、玻璃片、滤纸和____________, 剩余的钠应_______________;将一小块钠投入到硫酸铜溶液中,反应的离子方程式为______________________________________,观察到的现象为_____________(填写标号)。
a.钠浮在液面上四处游动 b.钠融成了一个闪亮的小球
c.溶液中有蓝色沉淀生成 d.溶液中有红色固体析出
(2)实验室制氯气的化学反应方程式为_________________________________;氯气为有毒气体,需用氢氧化钠溶液进行尾气处理,请完成该离子方程式____________, 该原理还可用于工业制______________。
(3)下列物质既能与盐酸反应,又能与烧碱溶液反应的是________________________________
a. Al b. Mg c. CH3COONH4 d. NaHCO3 e. Al2O3
【答案】煤油镊子放回原瓶略a b c略略漂白液a c d e
【解析】(1)钠极易和空气、水反应,且密度较小,所以保存钠要隔绝空气和水,钠的密度大于煤油且和煤油不反应,所以钠保存在煤油中;取用钠时,用镊子夹取钠,用小刀切割钠,用滤纸吸收煤油,将钠放置在玻璃片上切割;钠极易和空气、水反应且钠极易燃烧,所以剩余的钠要放回原瓶;钠的密度小于水,所以会浮在水面上,钠的熔点较低,钠和水反应生成氢氧化钠和氢气,且放出大量的热,放出的热使钠熔成小球,钠和水反应放出的氢气使钠受力不均,导致钠四处游动,氢氧化钠和硫酸铜发生复分解反应生成蓝色的氢氧化铜沉淀,故选abc,反应的离子方程式:2Na+2H2O+Cu2+═H2↑+Cu(OH)2↓+2Na+;
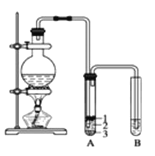
(2)在加热条件下,浓盐酸和二氧化锰反应生成氯化锰、氯气和水,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O,该原理还可以用于工业制取漂白液;
MnCl2+Cl2↑+2H2O,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2OH﹣═Cl﹣+ClO﹣+H2O,该原理还可以用于工业制取漂白液;
(3)这几种物质中既能和酸反应又能和碱反应的有:铝、醋酸铵、碳酸氢钠、氧化铝,故答案为acde。