题目内容
已知几种短周期元素的原子半径、常见的最高价和最低价如下表,下列说法中不正确的是 ( )
| 元素性质 | 元素编号 | ||||||
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | |
| 原子半径(nm) | 0.073 | 0.075 | 0.152 | 0.110 | 0.099 | 0.186 | 0.143 |
| 最高正化合价 | 无 | +5 | +1 | +5 | +7 | +1 | +3 |
| 最低负化合价 | -2 | -3 | 无 | -3 | -1 | 无 | 无 |
A.⑦的简单离子不是同周期元素离子半径最小的
B.气态氢化物的稳定性①>②
C.②的气态氢化物浓溶液可用于检验氯气管道的泄漏
D.阴离子的还原性④大于⑤,最高价氧化物的水化物的碱性③小于⑥
A
解析

练习册系列答案
相关题目
下列叙述正确的是
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.周期表中所有元素都是从自然界中发现的,过渡元素都是金属元素 |
| C.非金属元素形成的共价化合物中,原子的最外层都达到8电子稳定结构 |
| D.IA族与VIIA族元素间可形成共价化合物或离子化合物 |
下列判断正确的是( )
| A.第三、四周期同主族元素的原子序数相差8 |
| B.任何原子都是核外电子层数等于该元素在周期表中的周期数 |
| C.短周期中次外层电子数是最外层电子数2倍的元素一定是非金属元素 |
| D.短周期中族序数与周期数相同的元素是H、Be |
Q、W、X、Y、Z是原子序数依次增大的短周期元素,X的焰色反应呈黄色。Q元素的原子最外层电子数是其内层电子数的2倍。W、Z最外层电子数相同,Z的核电荷数是W的2倍。元素Y的合金是日常生活中使用最广泛的金属材料之一。下列说法正确的是( )
| A.原子半径的大小顺序:rX>rY>rW>rQ |
| B.X、Y的最高价氧化物的水化物之间不能反应 |
| C.Z、W最外层电子数都为6,最高化合价都为+6价 |
| D.元素Q和Z能形成QZ2型的共价化合物 |
J、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如表。已知J元素最低负化合价的绝对值与其原子最外层电子数相等,M是地壳中含量最多的金属元素。下列说法错误的是( )
| J | | |
| | | R |
B.工业上用电解熔融的M的氧化物方法来制备M
C.R、T两元素的气态氢化物中,T的气态氢化物更稳定
D.J、M、R、T元素最高价氧化物对应的水化物中酸性最强的是HTO4
据报道,2012年俄罗斯科学家再次合成117号元素。本次实验生成了6个新原子,其中5个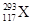 ,1个
,1个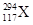 。下列关于
。下列关于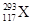 和
和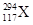 的说法不正确的是( )
的说法不正确的是( )
| A.是两种核素 | B.互为同位素 | C.中子数分别为176和177 | D.电子数相差1 |
X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法正确的是( )
| A.原子半径由小到大的顺序:X<Y<Z<W |
| B.Y单质在一定条件下可以与氧化铁发生置换反应 |
C.室温下,0.1 mol·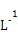 W的气态氢化物的水溶液的pH>1 W的气态氢化物的水溶液的pH>1 |
| D.Z的最高价氧化物能与水反应生成相应的酸 |
下列说法中,正确的是( )
| A.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| B.ⅥA族元素的氢化物中,最稳定的氢化物常温时为无色液体 |
| C.某主族元素X的气态氢化物化学式为HX,则其最高正价为+7价 |
| D.金属元素的原子只有还原性,金属阳离子只有氧化性 |
已知X为第三周期元素的原子,该原子要达到8电子稳定结构,则需要的电子数小于其次外层和最内层的电子数之差,且等于最内层电子数的整数倍。下列说法正确的是( )
| A.X元素最高价氧化物对应的水化物一定是强酸 |
| B.X元素的氢化物的化学式一定为H2X |
| C.X的单质一定是良好的半导体材料 |
| D.X元素的氧化物一定能与烧碱反应 |