题目内容
用NaHCO3和KHCO3组成的混合物分别与三份同浓度的盐酸进行反应,测得数据如下:
则下列结论中不正确的是 ( )
| A.盐酸物质的量浓度为1.5 mol/L, |
| B.15.7g混合物与盐酸反应后有剩余 |
| C.加入9.2 g混合物时消耗HCl 0.1 mol |
| D.混合物中NaHCO3和KHCO3的质量比为1 :1 |
D
解析试题分析:根据给定的数据可知第三份盐过量,盐酸不足量,放出气体的多少按照盐酸来求。根据离子方程式:H++HCO3-=H2O+CO2↑可得n(HCl)=3.36L÷22.4L/mol=0.15mol.所以C(HCl)=0.15mol/0.1L=1.5mol/L.第一份盐酸过量,盐不足量,放出放出气体的多少按照盐来求。假设混合物中NaHCO3和KHCO3的物质的量分别是X、Y,则84X+100Y=9.2;X+Y=0.1.解得X=0.05 Y="0.05" 即NaHCO3和KHCO3是按照1:1混合的。
考点:考查

 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案使用容量瓶配置溶液时,由于操作不当会引起误差,下列情况会使所配溶液浓度偏低的是 ( )
①用天平称量时所用砝码生锈
②用量筒量取所需浓溶液时,仰视刻度
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,俯视容量瓶的刻度线
⑥定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
| A.②⑤ | B.②③⑥ | C.①⑤⑥ | D.③⑥ |
设NA为阿伏加德罗常数的值,下列叙述正确的是 ( )
| A.标准状况下, 22.4 L H2O含有分子数为NA |
| B.分子总数为NA的N2、CO混合气体体积约为22.4 L,质量为28 g |
| C.常温常压下,1.6 g CH4含原子数为0.5NA |
| D.足量的CO2与39 g Na2O2发生反应,转移的电子数为NA |
铅笔芯的主要成分是石墨。如果铅笔芯写一个字消耗的石墨质量约为1×10-3g,。那么一个铅笔字含有的碳原子数约为
| A.5×1019个 | B.5×1022个 | C.2.5×1022个 | D.2.5×1019个 |
下列溶液中含Cl—的物质的量浓度最大的是( )
| A.50mL0.5mol/LKCl溶液 | B.200mL0.3mol/LMgCl2溶液 |
| C.100mL0.25mol/LAlCl3溶液 | D.500mL0.5mol/LHCl溶液 |
在标准状况下,相同体积的H2、O2、N2三种气体,有关叙述正确的是
| A.分子数相同 | B.质量相同 | C.原子数相同 | D.密度相同 |
标况下有以下四种气体:①6.72LCH4 ②3.01×1023个HCl分子 ③13.6克H2S ④0.2molNH3。下列对四种气体的关系从小到大表示不正确的是( )
| A.体积:④<①<③<② | B.质量: ④<①<③<② |
| C.物质的量:①<②<③<④ | D.氢原子数: ②<④<③<① |
下列表示物质结构的化学用语正确的是
| A.含7个中子的碳原子符号:12C |
B.NaCl的电子式:?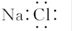 |
C.氯原子的结构示意图: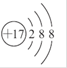 |
D.CSO的电子式: ? ? |
下列溶液中,Na+的物质的量浓度最大的是( )
| A.1 mL 0.5 mol·L-1的NaNO3溶液 | B.100 mL 0.01 mol·L-1的NaCl溶液 |
| C.100 mL 0.1 mol·L-1的NaOH溶液 | D.10 mL 0.1 mol·L-1的Na2SO4溶液 |