题目内容
20.氯水中存在多种分子和离子,可通过实验的方法加以确定.下列有关氯水中存在的粒子的说法错误的是( )| A. | 加入含有 NaHSO4的石蕊试液,红色褪去,说明有Cl2分子存在 | |
| B. | 加入有色布条后,有色布条褪色,说明有 HCIO 分子存在 | |
| C. | 氯水呈浅黄绿色,且有刺激性气味,说明有Cl2分子存在 | |
| D. | 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有 Cl-存在 |
分析 氯气通入溶液中,与水反应发生反应:Cl2+H2O═HCl+HClO,则氯水中存在:Cl2、H2O、HClO、H+、Cl-、ClO-、OH-,
A.溶液褪色是次氯酸具有漂白性导致的,而氯气不具有漂白性,故只能说明溶液中存在次氯酸;
B.次氯酸具有漂白性,有色布条褪色,说明存在HClO分子;
C.氯气为黄绿色气体,具有刺激性气味,则氯水呈浅黄色,且有刺激性气味;
D.加入硝酸酸化的AgNO3溶液产生白色沉淀,证明溶液中含有氯离子.
解答 解:氯气通入溶液中,与水反应发生Cl2+H2O═HCl+HClO,氯水中存在Cl2、H2O、HClO、H+、Cl-、ClO-、OH-,
A.加入含有 NaHSO4的石蕊试液,红色褪去,次氯酸具有漂白性,而氯气不具有漂白性,只能说明溶液中存在次氯酸,不能据此确定溶液中含有氯气分子,故A错误;
B.次氯酸具有漂白性,则加入有色布条后,有色布条褪色,说明有HClO分子存在,故B正确;
C.氯气为黄绿色气体,具有刺激性气味,则氯水呈浅黄色,且有刺激性气味,说明有Cl2分子存在,故C正确;
D.因AgCl不溶于水,则加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在,故D正确;
故选A.
点评 本题考查氯水的成分及氯水中各微粒的性质,题目难度中等,明确氯水中的各离子、分子的性质是解答本题的关键,试题侧重基础知识的考查,培养了学生灵活应用基础知识的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列指定反应的离子方程式正确的是( )
| A. | 用氨水吸收足量的SO2:0H-+S02═HS03- | |
| B. | 氢氧化钡溶液与硫酸氢钠溶液反应至恰好呈中性:Ba2++2H++SO42-+20H-═BaS04↓+2H20 | |
| C. | 在加热条件下浓盐酸与Mn02反应制取少量氯气:Mn02+2H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H20 | |
| D. | 向一定量的FeBr2溶液中通入过量Cl2:2Fe2++Cl2═2Fe3++2Cl- |
11.下列有关化学用语表示正确的是( )
| A. | 乙酸的结构简式为:C2H4O2 | B. | F-的结构示意图为: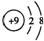 | ||
| C. | 中子数为17的氯原子:${\;}_{17}^{37}$CI | D. | NH3的电子式为: |
8.化学是以实验为基础的自然科学,化学实验设计和操作中必须十分重视师生安全问题和环境保护问题.下列实验问题处理方法正确的是( )
| A. | 制氧气时排水法收集氧气后出现倒吸现象,应立即停止加热 | |
| B. | 在气体发生装置上直接点燃乙炔气体时,不需先检验乙炔气体的纯度 | |
| C. | 白磷在空气中易自燃,用剩的白磷可溶解于CS2后倒入垃圾箱 | |
| D. | 给试管中的液体加热时,可加入碎瓷片或不时移动试管,以免暴沸伤人 |
15.下列变化过程中,无化学键断裂或生成的是( )
| A. | 石墨转化为金刚石 | B. | NaCl晶体溶于水 | ||
| C. | 碘升华 | D. | 久置的KI溶液呈黄色 |
5. 某校课外实验小组同学设计了如图装置制取并收集一瓶气体,请帮助该小组同学完成下表.
某校课外实验小组同学设计了如图装置制取并收集一瓶气体,请帮助该小组同学完成下表.
 某校课外实验小组同学设计了如图装置制取并收集一瓶气体,请帮助该小组同学完成下表.
某校课外实验小组同学设计了如图装置制取并收集一瓶气体,请帮助该小组同学完成下表.| 制取的气体 | 药 品 | 化学方程式 |
| O2 | H2O2、MnO2 | 2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑ |
| H2 | 乙醇、Na | 2CH2CH2OH+2Na=2CH3CH2ONa+H2↑ |
10.用NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | 用惰性电极电解CuCl2溶液,阴极析出16g铜时,线路中通过的电子数为NA | |
| B. | 标准状况下,2.24L乙醛完全燃烧所得CO2分子数约为0.2NA | |
| C. | 标准状况下,22.4L氖气中含有NA个氖原子 | |
| D. | 1mol甲基所含电子数约为8NA |

 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.