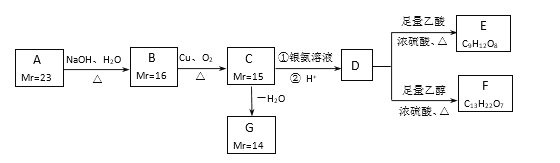
题目内容
【题目】下列叙述中,不正确的是
A. 共价化合物可能含有离子键
B. CCl4和NH3都是只含有极性键的共价化合物
C. Na2O2是含有非极性键的离子化合物
D. CaO和NaCl晶体熔化时要破坏离子键
【答案】A
【解析】
A、全部是共价键的化合物是共价化合物,错误;
B、CCl4和NH3都是只含有极性键的共价化合物,正确;
C、钠离子与过氧根离子之间是离子键,过氧根内部有非极性共价键,正确;
D、离子晶体融化破坏离子键,正确;
答案选A。

【题目】COS 和H2S 是许多煤化工产品的原料气。已知:
Ⅰ.COS(g)+H2(g)![]() H2S(g)+CO(g) ΔH=X kJ·mol-1;
H2S(g)+CO(g) ΔH=X kJ·mol-1;
I.CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
CO2(g)+H2(g) ΔH=-42 kJ·mol-1;
(1)断裂1mol分子中的化学键所需吸收的能量如下表所示:
分子 | COS(g) | H2(g) | CO(g) | H2S(g) | H2O(g) | CO2(g) |
能量/kJ·mol-1 | 1321 | 440 | 1076 | 680 | 930 | 1606 |
则X=_____________________。
(2)向10 L容积不变的密闭容器中充入1mol COS(g)、1mol H2(g)和1mol H2O(g),进行上述两个反应,在某温度下达到平衡,此时CO的体积分数为4%,且测得此时COS的物质的量为0.80mol,则该温度下反应I的平衡常数为_________________(保留两位有效数字)
(3)现有两个相同的2 L恒容绝热(与外界没有热量交换)密闭容器M、N,在M 中充入1mol CO和1molH2O,在N 中充入1molCO2和1molH2,均在700℃下开始按Ⅱ进行反应。达到平衡时,下列说法正确的是_________。
A.两容器中CO 的物质的量M>N
B.两容器中正反应速率M
C.容器M 中CO的转化率与容器N 中CO2的转化率之和小于1
D.两容器中反应的平衡常数M>N
(4)氢硫酸、碳酸均为二元弱酸,其常温下的电离常数如下表:
H2CO3 | H2S | |
Ka1 | 4.4× 10-7 | 1.3×10-7 |
Ka2 | 4.7× 10-11 | 7.1×10-15 |
煤的气化过程中产生的H2S 可用足量的Na2CO3溶液吸收,该反应的离子方程式为______________;常温下,用100mL0.2mol·L-1InaOH溶液吸收448mL(标况)H2S气体,反应后溶液中离子浓度从大到小的顺序为__________________________________。
(5)25℃时,用Na2S沉淀Cu2+、Sn2+两种金属离子 (M2+),所需S2-最低浓度的对数值1gc(S2-)与Igc(M2+

①25℃时Ksp(CuS)=_______________。
②25℃时向50mL的Sn2+、Cu2+浓度均为0.01mol/L的混合溶液中逐滴加入Na2S溶液,当Na2S溶液加到150mL时开始生成SnS沉淀,则此时溶液中Cu2+浓度为_____________mol/L。
【题目】亚硝酰氯(NOCl,熔点:-64.5℃,沸点:-5.5℃)是一种黄色气体,遇水易水解。可用于合成清洁剂、触媒剂及中间体等。实验室可由氯气与一氧化氮在常温常压下合成。
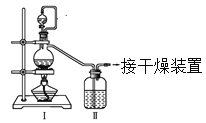
(1)甲组的同学拟制备原料气NO和Cl2,制备装置如下图所示:
为制备纯净干燥的气体,下表中缺少的药品是:
装置Ⅰ | 装置Ⅱ | ||
烧瓶中 | 分液漏斗中 | ||
制备纯净Cl2 | MnO2 | ①________ | ②________ |
制备纯净NO | Cu | ③________ | ④________ |
(2)乙组同学利用甲组制得的NO和Cl2制备NOCl,装置如图所示:
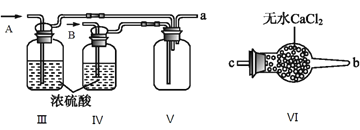
①为了使气体充分反应,从A处进入的气体是____________(填Cl2或NO)。
②装置连接顺序为a→_______________________(按气流自左向右方向,用小写字母表示)。
③装置Ⅲ、Ⅳ除可干燥NO、Cl2外,另一个作用是________________________。
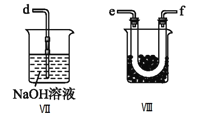
④装置Ⅷ的烧杯中盛放的试剂是_____________________(填编号①水②冰水③冰盐水)
⑤装置Ⅶ中吸收尾气时,NOCl发生反应的化学方程式为___________________________________。
(3)丙组同学查阅资料,查得王水是浓硝酸与浓盐酸的混酸,一定条件下混酸可生成亚硝酰氯和氯气,该反应的化学方程式为________________________________。