题目内容
13.钴酸锂(LiCoO2)锂离子电池是一种应用广泛的新型电池,实验室尝试用废旧钴酸锂离子电池回收铝,铁,铜,钴及锂元素,其流程如下:
已知:①Fe3++3C2O42-═[Fe(C2O4)3]3-,[Fe(C2O4)3]3-遇酸分解,重新生成Fe3+
②Co3+有强氧化性,易被还原为Co2+
③废旧电池中铝、铁以单质形式存在
(1)碱浸泡过程中发生反应的离子方程式是2Al+2OH-+2H2O═2AlO2-+3H2↑.
(2)滤液A中溶质(除盐酸外)主要成分的化学式是LiCl、CoCl2、FeCl2;向滤液A中加入草酸铵溶液,使钴元素以CoC2O4形式沉淀析出,判断沉淀完全的方法和现象是静置,取上层清液加入草酸铵溶液,若没有沉淀生成,则沉淀完全.
(3)滤液A到滤液B的步骤中,加入氧化剂不能选用B原因是会引入杂质NO3-.
A.Cl2 B.HNO3C.H2O2
(4)生成Li2 CO3的化学方程式为2LiCl+Na2CO3═Li2CO3+2NaCl.
(5)上述流程有一缺点,第一次使用到盐酸时,会有少量黄绿色气体生成,请写出该反应的化学方程式2LiCoO2+8HCl═2LiCl+2CoCl2+Cl2↑+4H2O.
(6)某温度下Ksp[Fe(OH)3]=2.097×10-39 mol4•L-4,将0.01mol•L-1的FeCl3溶液与0.001mol•L-1的NaOH溶液等体积混合,请通过计算说明能否形成沉淀c(Fe3+)•c3(OH-)=($\frac{1}{2}$×0.01)×($\frac{1}{2}$×0.001)3=6.25×10-13 mol4•L-4>Ksp[Fe(OH)3],能生成Fe(OH)3沉淀.
分析 废旧钴酸锂镍离子电池主要含有Fe、Al、Cu的单质和LiCoO2,初步处理,加碱浸泡,铝和碱液反应生成偏铝酸盐和氢气,固体残渣为:Fe、Cu的单质和LiCoO2,加盐酸Fe+2H+=Fe2++H2↑,2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2↑+4H2O,沉淀为Cu,滤液A为Fe2+、Li+、Co3+、Cl-,FeC2O4难溶于水,向滤液A中加入H2O2,氧化Fe2+为Fe3+,加入草酸铵,过滤沉淀为CoC2O4•2H2O,滤液B为:Fe3+、Li+、Cl-,加入碳酸钠,发生的离子反应为2Li++CO32-=Li2CO3↓,滤液C为Fe3+、Cl-,加入氧化剂防止铁离子被还原得氯化铁溶液,
(1)碱浸泡过程中铝和碱液反应生成偏铝酸盐溶液;
(2)LiCoO2中Li为+1价,Co为+3价,具有氧化性,HCl中-1价的氯具有还原性,Co(+3→+2),Cl(-1→0);
(3)不能引入新的杂质;
(4)氯化锂与碳酸钠反应生成碳酸锂;
(5)黄绿色气体为氯气,钴酸锂能将盐酸氧化为氯气;
(6)离子积大于Ksp能形成沉淀.
解答 解:废旧钴酸锂镍离子电池主要含有Fe、Al、Cu的单质和LiCoO2,初步处理,加碱浸泡,铝和碱液反应生成偏铝酸盐和氢气,固体残渣为:Fe、Cu的单质和LiCoO2,加盐酸Fe+2H+=Fe2++H2↑,2LiCoO2+8H++2Cl-=2Li++2Co2++Cl2↑+4H2O,沉淀为Cu,滤液A为Fe2+、Li+、Co3+、Cl-,FeC2O4难溶于水,向滤液A中加入H2O2,2Fe2++H2O2+2H+=2Fe3++2H2O,氧化Fe2+为Fe3+,加入草酸铵,过滤沉淀为CoC2O4•2H2O,滤液B为:Fe3+、Li+、Cl-,加入碳酸钠,发生的离子反应为2Li++CO32-=Li2CO3↓,滤液C为Fe3+、Cl-,加入氧化剂防止铁离子被还原得氯化铁溶液,
(1)铝和碱液反应生成偏铝酸盐和氢气,所以碱浸泡过程中发生反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;
(2)LiCoO2中Li为+1价,Co为+3价,具有氧化性,HCl中-1价的氯具有还原性,向固体残渣中加入盐酸时,Co(+3→+2),Cl(-1→0),最小公倍数为1,因Cl2为双原子分子,所以LiCoO2前系数为2,根据原子守恒,未知物为水,所以反应为:2LiCoO2+8HCl=2LiCl+2CoCl2+Cl2↑+4H2O.滤液A为Fe2+、Li+、Co3+、Cl-,静置,取上层清液加入草酸铵溶液,若没有沉淀生成,则沉淀完全,故答案为:CoCl2、FeCl2;静置,取上层清液加入草酸铵溶液,若没有沉淀生成,则沉淀完全;
(3)FeC2O4难溶于水,[Fe(C2O4)3]3-遇酸转化为Fe3+,为避免沉淀Fe2+,需氧化亚铁离子,H2O2具有氧化性,Fe2+具有还原性,向滤液A中加入H2O2的作用是氧化Fe2+为Fe3+;发生的反应为:2Fe2++H2O2+2H+=2Fe3++2H2O;氯气的还原产物为氯离子,加入硝酸会引入杂质NO3-,故答案为:B;会引入杂质NO3-;(4)氯化锂与碳酸钠反应生成碳酸锂,化学方程式为2LiCl+Na2CO3═Li2CO3+2NaCl,故答案为:2LiCl+Na2CO3═Li2CO3+2NaCl;
(5)黄绿色气体为氯气,黄绿色气体为氯气,钴酸锂能将盐酸氧化为氯气,反应的化学方程式:2LiCoO2+8HCl═2LiCl+2CoCl2+Cl2↑+4H2O,故答案为:2LiCoO2+8HCl═2LiCl+2CoCl2+Cl2↑+4H2O;
(6)由Ksp可知,c(Fe3+)•c3(OH-)=($\frac{1}{2}$×0.01)×($\frac{1}{2}$×0.001)3=6.25×10-13 mol4•L-4>2.097×10-39,能生成Fe(OH)3沉淀,故答案为:c(Fe3+)•c3(OH-)=($\frac{1}{2}$×0.01)×($\frac{1}{2}$×0.001)3=6.25×10-13 mol4•L-4>Ksp[Fe(OH)3],能生成Fe(OH)3沉淀.
点评 本题考查物质的分离和提纯,侧重考查工艺流程的分析,涉及沉淀的生成与物质的性质、基本实验操作等知识点,明确物质性质是解本题关键,知道每一步发生的反应及分离方法,题目难度中等.

| A. | $\frac{28m}{n}$ | B. | $\frac{14m}{n}$ | C. | $\frac{n}{28m}$ | D. | $\frac{n}{14m}$ |
| A. | 2-甲基丙烷 | B. | 2,2,3,3-四甲基丁烷 | ||
| C. | 2,2-二甲基丁烷 | D. | 2,2-二甲基丙烷 |

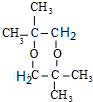 ,该分子的核磁共振氢谱有2种峰.
,该分子的核磁共振氢谱有2种峰. .F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.
.F→G的反应:(CH3)2C(OH)-CHO+2Cu(OH)2$\stackrel{△}{→}$(CH3)2C(OH)-COOH+Cu2O↓+2H2O.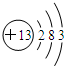 ②S2-
②S2-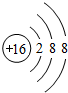
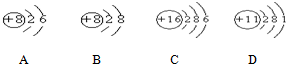
 .
.