题目内容
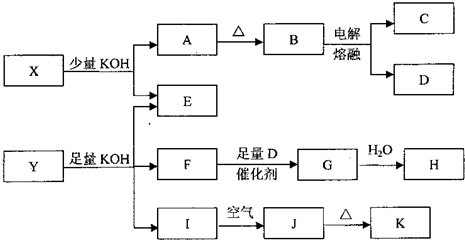
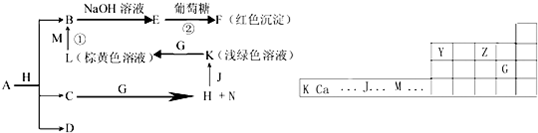
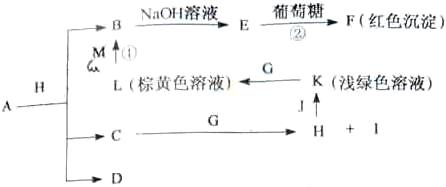
(14分)各物质之间的转换关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子量外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,l有漂白作用,反应①常用于制作印刷电路板。
![]()
![]()
![]() 请回答下列问题:
请回答下列问题:
![]() (1)写出A的化学式 , C的电子式 。
(1)写出A的化学式 , C的电子式 。
![]() (2)比较Y与Z的原子半径大小 > (填写元素符号)。
(2)比较Y与Z的原子半径大小 > (填写元素符号)。
![]() (3)写出反应②的化学方程式(有机物用结构简式表示) ,举出该反应的一个应用实例 。
(3)写出反应②的化学方程式(有机物用结构简式表示) ,举出该反应的一个应用实例 。
![]() (4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式 。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式 。
![]() (5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称 、 、 。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面体,请写出N及其2种同素异形体的名称 、 、 。
![]() 答案(1)Cu2(OH)2CO3 [Cu(OH)2?CuCO3]或CuCO3
答案(1)Cu2(OH)2CO3 [Cu(OH)2?CuCO3]或CuCO3 ![]()
![]() (2) C>O
(2) C>O
![]() (3)CH2OH(CHOH)4CHO + 2Cu(OH)2
(3)CH2OH(CHOH)4CHO + 2Cu(OH)2 ![]() CH2OH(CHOH)4COOH + Cu2O↓+ 2H2O
CH2OH(CHOH)4COOH + Cu2O↓+ 2H2O
![]() 医学上可用这个反应检验尿液中的葡萄糖。
医学上可用这个反应检验尿液中的葡萄糖。
![]() (4)3Cu2O + 14HNO3
(4)3Cu2O + 14HNO3 ![]() 6Cu(NO3)2 + 2NO↑+ 7H2O
6Cu(NO3)2 + 2NO↑+ 7H2O
![]() (5)金刚石、石墨、富勒烯(C60)或碳纳米管等。
(5)金刚石、石墨、富勒烯(C60)或碳纳米管等。
![]() 【解析】从反应图中寻找突破口,E与葡葡糖生成红色沉淀F,则E应为Cu(OH)2,而B为Cu2+,反应①为印刷电路板,L为棕黄色溶液,由此可推出:M应为Cu,L为FeCl3 。G为黄绿色气体,则为Cl2,K为浅绿色,则为Fe2+溶液。X的原子半径最小,则为H,D为非可燃性气体,可推为CO2,C和O的最外层电子之和刚好为10。C为H、C、O中的两种组成的化合物,且可以与Cl2反应,故应为H2O,生成H为HCl,I为HClO(具有漂白性),HCl与J(Fe)可生成FeCl2溶液。(1)A + HCl
【解析】从反应图中寻找突破口,E与葡葡糖生成红色沉淀F,则E应为Cu(OH)2,而B为Cu2+,反应①为印刷电路板,L为棕黄色溶液,由此可推出:M应为Cu,L为FeCl3 。G为黄绿色气体,则为Cl2,K为浅绿色,则为Fe2+溶液。X的原子半径最小,则为H,D为非可燃性气体,可推为CO2,C和O的最外层电子之和刚好为10。C为H、C、O中的两种组成的化合物,且可以与Cl2反应,故应为H2O,生成H为HCl,I为HClO(具有漂白性),HCl与J(Fe)可生成FeCl2溶液。(1)A + HCl![]() Cu2+ + H2O + CO2,由元素守恒可知,A可以CuCO3或碱式碳酸铜均可。(2)Y为C,Z为N,两者位于同一周期,前者的半径大,即C>N。(3)葡萄糖含有醛基,可以与Cu(OH)2生成砖红色沉淀。(4)F为Cu2O,与HNO3反应,生成Cu(NO3)2,且生成无色气体,应为NO,然后根据得失电子守恒配平即可。(5)CO2可以还原成正四面体结构的晶体N,即化合价降低,显然生成C,应为金刚石。它的同素异形体必须为含碳的单质。
Cu2+ + H2O + CO2,由元素守恒可知,A可以CuCO3或碱式碳酸铜均可。(2)Y为C,Z为N,两者位于同一周期,前者的半径大,即C>N。(3)葡萄糖含有醛基,可以与Cu(OH)2生成砖红色沉淀。(4)F为Cu2O,与HNO3反应,生成Cu(NO3)2,且生成无色气体,应为NO,然后根据得失电子守恒配平即可。(5)CO2可以还原成正四面体结构的晶体N,即化合价降低,显然生成C,应为金刚石。它的同素异形体必须为含碳的单质。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案