题目内容
19.工业上可利用合成气(CO和H2的混合气体)生产甲醇.已知:CO(g)+2H2(g)?CH3OH(g)△H=-92.9kJ/mol.一定条件下,该反应在一体积固定的密闭容器中达到平衡.下列说法正确的是( )| A. | 该反应的△S>0 | |
| B. | 该反应在任何温度下均能自发进行 | |
| C. | 向容器中充入少量He,平衡向正反应方向移动 | |
| D. | 升高温度平衡向逆反应方向移动 |
分析 A、根据方程式中气体的计量数的变化判断;
B、化学反应能否自发进行,取决于焓变和熵变的综合判据;
C、向容器中充入少量He,容器体积不变,反应物浓度不变;
D、根据温度对平衡的影响分析.
解答 解:A、已知:CO(g)+2H2(g)?CH3OH(g)△H=-92.9kJ/mol,由方程式中气体的计量数可知反应后气体物质的量减小,所以熵减小,即△S<0,故A错误;
B、化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T•△S<0时,反应能自发进行;已知△H<0,△S<0所以反应的在高温时能自发进行,故B错误;
C、向容器中充入少量He,容器体积不变,反应物浓度不变,正逆反应速率不变,所以平衡不移动,故C错误;
D、已知该反应△H<0,所以升高温度平衡逆向移动,故D正确;
故选D.
点评 本题考查反应热与焓变,化学平衡移动,反应方向的判断,题目难度不大,注意自由能判据的应用.

练习册系列答案
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案
相关题目
9.50g质量分数为19%的氧化镁溶液中Cl-的物质的量为( )
| A. | 0.01mol | B. | 0.1mol | C. | 0.02mol | D. | 0.2mol |
7.下列叙述中错误的是( )
| A. | H2SO4的摩尔质量是98 g•mol-1 | |
| B. | 2mol NO和2mol N2气体体积相等 | |
| C. | 等质量的O2和O3中所含氧原子个数相同 | |
| D. | 等物质的量的CO和CO2中所含碳原子数相等 |
14.下列关于反应能量的说法正确的是( )
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量大于生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
4.下列有机反应属于加聚反应的是( )
| A. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | B. | nCH2=CH2$\stackrel{一定条件}{→}$ | ||
| C. |  +HNO3$→_{加热}^{浓硫酸}$ +HNO3$→_{加热}^{浓硫酸}$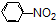 +H2O +H2O | D. | 2CH3CH2OH+2Na→2CH3CH2ONa+H2↑ |
9.下列反应中符合图示能量变化的是( )
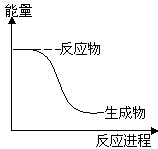

| A. | 电解Al2O3得到Al和O2 | B. | HCl分解为H2和Cl2 | ||
| C. | Al和Fe2O3在高温条件下反应 | D. | Ba(OH)2•8H2O和NH4Cl晶体混合反应 |