题目内容
【题目】纳米铜是一种性能优异的超导材料,以辉铜矿(主要成分为Cu2S)为原料制备纳米铜粉的工艺流程如图1所示。

(1)用黄铜矿(主要成分为CuFeS2)、废钢渣和稀硫酸共网作用可获得较纯净的Cu2S,其原理如图2所示,该反应的离子方程式为__________。

(2)从辉铜矿中浸取铜元素时,可用FeC13溶液作浸取剂。
①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,每生成1molCuCl2,反应中转移电子的物质的量为____;浸取时,在有氧环境下可维持Fe3+较高浓度,有关反应的离子方程式为__________。
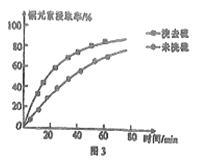
②浸取过程中加入洗涤剂溶解硫时,铜元素浸取率的变化如图3所示,未洗硫时铜元素浸取率较低,其原因是__________。
(3)“萃取”时,两种金属离子萃取率与PH的关系如图4所示。当pH>1.7时,pH越大,金属离子萃取率越低,其中Fe3+萃取率降低的原因是__________。

(4)用“反萃取”得到的CuSO4溶液制备纳米铜粉时,该反应中还原产物与氧化产物的质量之比为__________。
(5)在萃取后的“水相”中加入适量氨水,静置,再经过滤、_______、干燥、_____等操作可得到Fe2O3产品。
【答案】 CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑ 2mol 4Fe2++O2+4H+=4Fe3++2H2O 生成的硫覆盖在Cu2S表面,阻碍浸取 Fe3+水解程度隨PH的升高而增大 32:7 洗涤 煅烧(或灼烧)
【解析】(1)根据图示,用黄铜矿(主要成分为CuFeS2)、废钢渣和稀硫酸共网作用可获得较纯净的Cu2S,同时生成Fe2+和H2S,反应的离子方程式为:CuFeS2+Cu+2H+=Cu2S+Fe2++H2S↑。(2)①反应:Cu2S+4FeCl3=2CuCl2+4FeCl2+S,在反应中,FeCl3中铁元素的化合价由+3降低为+2价,Cu2S中铜元素的化合价由+1升高为+2价,硫元素的化合价由—2升高到0价,化合价升高数=化合价降低数=4,每生成1mol CuCl2转移电子的物质的量为2mol。浸取时,在有氧环境下,亚铁离子被氧化,生成铁离子,反应的方程式为:4Fe2++O2+4H+=4Fe3++2H2O ②浸取过程中,洗涤硫和未洗涤硫相比较, 未洗硫时铜元素浸取率较低原因是生成的硫覆盖在Cu2S表面,阻碍浸取。(3) Fe3+的水解程度随着pH的升高而增大,萃取率越低。 (4)在碱性条件下,Cu2+和N2H4反应生成氮气和铜,反应为:2 Cu2++ N2H4+4OH-=2Cu+N2+4H2O,反应中还原产物是Cu,氧化产物是N2,质量之比为(2×64):28=32:7. (5)萃取后“水相”中含有铁离子,加入氨水反应生成氢氧化铁沉淀,煅烧后可得到氧化铁,方法为:在萃取后的“水相”中加入适量氨水,静置、过滤、洗涤、干燥、煅烧。